题目内容
【题目】实验室用如图1装置制取氯气,并用氯气进行实验.回答下列问题: 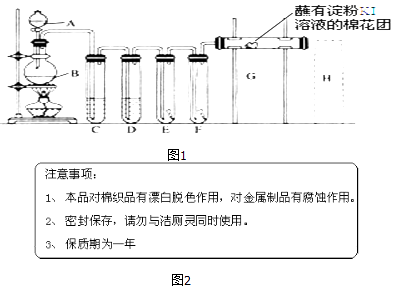
(1)A中盛有浓盐酸,B中盛有MnO2 , 写出反应的化学方程式 .
(2)D中放入浓H2SO4 , 其目的是 .
(3)E中为红色干布条,F中为红色湿布条,可观察到的现象是: , 对比E和F中现象的差异可得出的结论及解释是 .
(4)G处的现象是 .
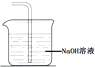
(5)画出H处尾气吸收装置图并注明试剂 .
(6)家庭中常用消毒液(主要成分NaClO)与洁厕灵(主要成分盐酸)清洁卫生.某品牌消毒液包装上说明如图2. ①“与洁厕灵同时使用”会产生有毒的氯气,写出反应的离子方程式: .
②需“密闭保存”的原因;
③分析“对金属制品有腐蚀作用”的原因可能是;
(7)现在有一种名为“净水丸”的产品也能对饮用水进行快速的杀菌消毒,药丸通常分内外两层.外层的优氯净 Cl2Na(NCO)3先与水反应,生成次氯酸起杀菌消毒作用;几分钟后,内层的亚硫酸钠(Na2SO3)溶出,可将水中的余氯(次氯酸等)除去. ①亚硫酸钠将水中多余次氯酸除去的离子反应方程式为 .
②亚硫酸钠溶液在空气中易变质,请完整写出检验亚硫酸钠溶液是否变质的实验操作方案 .
【答案】
(1)MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(2)干燥氯气
(3)E中布条不褪色,F中布条褪色;氯气不具有漂白性,具有漂白性的为次氯酸
(4)棉花团变蓝
(5)
(6)Cl﹣+ClO﹣+2H+=Cl2↑+H2O;消毒液的有效成分NaClO能与空气中的CO2作用,使其变质; NaClO有强氧化性,而一般金属具有较强还原性
(7)SO32﹣+HClO═SO42﹣+Cl﹣+H+;取适量固体于试管,加水溶解,滴加过量盐酸至无气体放出,再滴加BaCl2,有白色沉淀生成证明试样已经变质.
【解析】解:(1)MnO2与浓盐酸在加热条件下发生氧化还原反应生成氯气、氯化锰和水,方程式:MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
所以答案是:MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O;(2)D中浓硫酸作用为干燥氯气,防止水蒸气对氯气漂白性检验造成干扰;
MnCl2+Cl2↑+2H2O;(2)D中浓硫酸作用为干燥氯气,防止水蒸气对氯气漂白性检验造成干扰;
所以答案是:干燥氯气;(3)干燥的氯气依次通过E中红色干布条,F中红色湿布条,看到现象为E中布条不褪色,F中布条褪色,说明氯气不具有漂白性,具有漂白性的为次氯酸;
所以答案是:E中布条不褪色,F中布条褪色;氯气不具有漂白性,具有漂白性的为次氯酸;(4)氯气具有强的氧化性,与碘化钾反应生成单质碘,碘遇到淀粉变蓝,所以看到现在为:棉花团变蓝;
所以答案是:棉花团变蓝;(5)氯气有毒不能直接排放到空气中,氯气能够与碱反应,可以用氢氧化钠溶液吸收过量的氯气,装置如图所示:  ;
;
所以答案是:  ;(6)①次氯酸根离子与氯离子发生氧化还原反应生成氯气和水,离子方程式:Cl﹣+ClO﹣+2H+=Cl2↑+H2O;
;(6)①次氯酸根离子与氯离子发生氧化还原反应生成氯气和水,离子方程式:Cl﹣+ClO﹣+2H+=Cl2↑+H2O;
所以答案是:Cl﹣+ClO﹣+2H+=Cl2↑+H2O;
②消毒液有效成分是次氯酸盐与二氧化碳和水生成的次氯酸,次氯酸不稳定,见光分解,所以应该密封保存;
所以答案是:消毒液的有效成分NaClO能与空气中的CO2作用,使其变质;
③NaClO具有漂白作用,利用了NaClO的氧化性,而金属具有还原性,发生了氧化还原反应,对金属腐蚀,
所以答案是:NaClO有强氧化性,而一般金属具有较强还原性;(7)①亚硫酸根离子与次氯酸反应生成硫酸根离子、氯离子,反应的离子方程式为:SO32﹣+HClO═SO42﹣+Cl﹣+H+,
所以答案是:SO32﹣+HClO═SO42﹣+Cl﹣+H+;
②亚硫酸钠溶液在空气中易变质,则溶液中会存在硫酸根离子,所以判断亚硫酸钠溶液是否变质的方法为:取适量固体于试管,加水溶解,滴加过量盐酸至无气体放出,再滴加BaCl2,有白色沉淀生成证明试样已经变质,
所以答案是:取适量固体于试管,加水溶解,滴加过量盐酸至无气体放出,再滴加BaCl2,有白色沉淀生成证明试样已经变质.
【考点精析】根据题目的已知条件,利用氯气的实验室制法的相关知识可以得到问题的答案,需要掌握实验室制法:MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】如表是元素周期表的一部分,回答下列问题
周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
1 | |||||||
2 | ① | ② | ③ | ||||
3 | ④ | ⑤ | ⑥ | ||||
(1)表中元素②最简单氢化物的电子式为 , 元素③和⑤对应的氢化物较稳定的是(写化学式,下同),元素②和⑥对应最高价氧化物的水化物酸性较强的是 .
(2)工业生产单质④的原理是(用化学方程式表示).
(3)已知某些不同族元素的性质也有一定的相似性,如元素①与元素④的氢氧化物有相似的性质.写出元素①的氢氧化物与NaOH溶液反应的化学方程式: .
(4)0.2mol的单质⑥与100mL2molL﹣1的FeBr2溶液反应,则被氧化的Fe2+和Br﹣的物质的量之比是 .
【题目】分类法是研究化学的一种重要方法,下列乙中的物质与甲的分类关系匹配的是( )
选项 | 甲 | 乙 |
A | 干燥剂 | 浓硫酸、石灰石、无水氯化钙 |
B | 弱电解质 | 冰醋酸、氨气、水 |
C | 空气质量检测物质 | 氮氧化物、二氧化硫、PM2.5 |
D | 酸性氧化物 | 三氧化硫、一氧化碳、二氧化硅 |
A. A B. B C. C D. D