题目内容
【题目】铁及其化合物在日常生活中应用广泛。
(1)取5.6 g的生铁与足量的稀硫酸混合反应,无论怎样进行实验,最终收集的气体体积均小于2.24 L(标准状况),最主要的原因是____________________________;所得溶液在长时间放置过程中会慢慢出现浅黄色,试用离子方程式解释这一变化的原因:________________________________。
(2)氧化铁是重要的工业颜料,下面是制备氧化铁的一种方法(铁屑表面常附着油污),其流程如下:
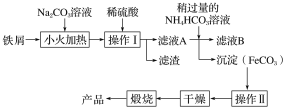
①操作Ⅰ的名称是________;操作Ⅱ为洗涤,洗涤操作的具体方法为__________________。
②滤液A中加入稍过量的NH4HCO3溶液,生成沉淀的同时有一种气体(能使澄清石灰水变浑浊)产生,写出其化学方程式: __________________________________。
(3)如果煅烧不充分,产品中将有FeO存在,称取3.0 g氧化铁产品,加酸溶解,在250 mL容量瓶中定容;量取25.00 mL待测溶液于锥形瓶中,用酸化的0.010 00 mol·L-1 KMnO4溶液滴定至终点,重复滴定2~3次,消耗酸性KMnO4溶液体积的平均值为20.00 mL。
①该实验中的KMnO4溶液需要酸化,用于酸化的酸是________(填序号)。
a.硝酸 b.盐酸 c.硫酸
②上述产品中Fe2O3的质量分数为________。
【答案】生铁中含有碳等杂质 4Fe2++O2+4H+===4Fe3++2H2O 过滤(溶解过滤也可) 沿玻璃棒往漏斗中加入适量蒸馏水至浸没沉淀,让蒸馏水自然流下,重复2~3次 FeSO4+2NH4HCO3===FeCO3↓+(NH4)2SO4+CO2↑+H2O c 76%
【解析】
(1)生铁是铁碳合金,碳与稀硫酸不反应;Fe2+具有还原性,易被氧气氧化为Fe3+;(2)铁屑用纯碱溶液洗去油污,加稀硫酸充分反应,经过过滤分离,在滤液中加入过量的碳酸氢铵溶液得到碳酸亚铁,再经过过滤、洗涤,然后再干燥,煅烧得到氧化铁;(3)①硝酸具有强氧化性,酸性高锰酸钾溶液具有强氧化性,能氧化氯离子;②FeO与KMnO4反应的关系式是5FeO![]() KMnO4,根据关系式计算Fe2O3的质量分数。
KMnO4,根据关系式计算Fe2O3的质量分数。
(1)生铁是铁碳合金,碳与稀硫酸不反应,所以取5.6 g的生铁与足量的稀硫酸混合反应,无论怎样进行实验,最终收集的气体体积均小于2.24 L(标准状况);Fe2+具有还原性,易被氧气氧化为Fe3+,反应的离子方程式是4Fe2++O2+4H+===4Fe3++2H2O;(2) ①操作Ⅰ是固液分离,名称是过滤;洗涤操作的具体方法为沿玻璃棒往漏斗中加入适量蒸馏水至浸没沉淀,让蒸馏水自然流下,重复2~3次;②硫酸亚铁溶液中加入稍过量的NH4HCO3溶液生成碳酸亚铁沉淀和二氧化碳气体和硫酸铵,反应化学方程式是FeSO4+2NH4HCO3===FeCO3↓+(NH4)2SO4+CO2↑+H2O;(3)①亚铁离子具有还原性,硝酸具有强氧化性,不能用硝酸酸化,酸性高锰酸钾溶液具有强氧化性,能氧化氯离子,不能用盐酸酸化,故选c;②设样品中FeO的质量为xg
5FeO![]() KMnO4
KMnO4
360g 1mol
xg 0.02L![]() 0.01mol·L-1
0.01mol·L-1![]() 10
10
![]()
x=0.72g,Fe2O3的质量位3.0 g-0.72g=2. 28g,产品中Fe2O3的质量分数为![]() 。
。

 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案