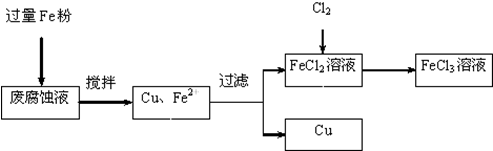
题目内容
13.下列物质或指定物质主要成分与化学式对应正确的是( )| A. | 明矾--Al2(SO4)3•12H2O | B. | 漂白粉--NaClO | ||
| C. | 纯碱--NaHCO3 | D. | 水煤气--CO、H2 |
分析 A、明矾为十二水合硫酸铝钾;
B、漂白粉的主要成分是次氯酸钙和氯化钙;
C、纯碱为碳酸钠;
D、水煤气是一氧化碳与氢气的混合气体.
解答 解:A、明矾为十二水合硫酸铝钾,化学式为:KAl(SO4)2•12H2O,故A错误;
B、漂白粉的主要成分是次氯酸钙,还含有氯化钙,化学式分别为:Ca(ClO)2、CaCl2,故B错误;
C、纯碱为碳酸钠,化学式为:Na2CO3,故C错误;
D、水煤气是一氧化碳与氢气的混合气体,故D正确,
故选D.
点评 本题考查了化学物质的名称与化学式的关系,题目难度不大,试题侧重基础知识的考查,注意掌握常见化学物质的名称、化学式,试题培养了学生灵活应用所学知识的能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
3. 下列①②对应的试剂(或条件)不能完成实验目的是( )
下列①②对应的试剂(或条件)不能完成实验目的是( )
 下列①②对应的试剂(或条件)不能完成实验目的是( )
下列①②对应的试剂(或条件)不能完成实验目的是( )| 实验目的 | 试剂(或条件) | |
| A | 温度对Na2S2O3与H2SO4反应速率的影响 | ①热水浴②冷水浴 |
| B | 用Na块检验乙醇分子存在不同与烃分子里的氢原子 | ①乙醇②煤油 |
| C | 用酸化的AgNO3溶液检验来自水中Cl-能否蒸馏除去 | ①自来水②蒸馏水 |
| D | 用溴水检验苯的同系物种取代基对苯活性有影响 | ①苯②甲苯 |
| A. | A | B. | B | C. | C | D. | D |
4.25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 使酚酞变红色的溶液:NH4+、Ca2+、NO3-、SO42- | |
| B. | c(OH-)=1×10-13 mol•L-1的溶液:Na+、K+、ClO-、SO42- | |
| C. | 0.1 mol•L-1 FeCl2溶液:K+、Na+、SO42-、NO3- | |
| D. | 0.1 mol•L-1 KMnO4溶液:Na+、Mg2+、NO3-、SO32- |
1.有机化合物A只由C、H两种元素组成且能使溴水褪色,其相对分子质量为28,A、B、C、D、E有如下关系:
则下列判断错误的是( )

则下列判断错误的是( )
| A. | B中含有的官能团为羟基 | B. | 可用碳酸钠溶液区别B、D | ||
| C. | D中含有C═O键,E的名称为乙酸乙酯 | D. | B+D→E反应的装置如图 |
8.某烃在标准状况下测得密度为3.75g/L,根据各类烃的通式可以推出该烃的化学式( )
| A. | C3H8 | B. | C4H10 | C. | C5H8 | D. | C6H12 |
18.下列实验装置或操作正确的是( )
| A. | 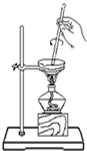 从碘水中分离出碘 | B. |  检验试液中NH4+的存在 | ||
| C. | 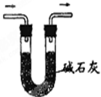 干燥SO2气体 | D. |  收集HCl气体 |