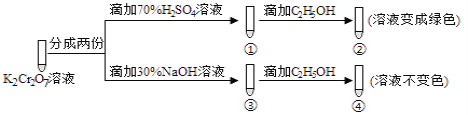
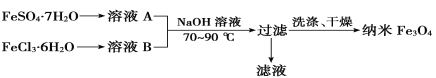
题目内容
【题目】合成氨的能量示意图如下:
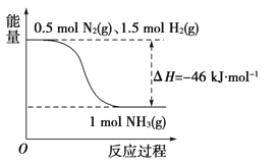
(1)已知分别破坏1 mol N![]() N键、1 mol H-H键时需要吸收的能量为946 kJ、436 kJ,则破坏1 mol N-H键需要吸收的能量为________ kJ。
N键、1 mol H-H键时需要吸收的能量为946 kJ、436 kJ,则破坏1 mol N-H键需要吸收的能量为________ kJ。
(2)N2H4可视为NH3分子中的H被—NH2取代的产物。发射卫星时以N2H4(g)为燃料、NO2为氧化剂,二者反应生成N2和H2O(g)。
已知:N2(g)+2O2(g)===2NO2(g)ΔH1=+67.7 kJ·mol-1
N2H4(g)+O2(g)===N2(g)+2H2O(g)ΔH2=-534 kJ·mol-1
则1 mol N2H4与NO2完全反应的热化学方程式为____________________________________。
【答案】391 N2H4(g)+NO2(g)===3/2N2(g)+2H2O(g) ΔH=-567.85 kJ·mol-1
【解析】
(1)ΔH=反应物的键能之和—生成物的键能之和=946+3×436—6×N—H键键能=-92 kJ·mol-1,解得N—H键键能为391 kJ·mol-1;
(3)由①N2(g)+2O2(g)===2NO2(g)ΔH1=+67.7 kJ·mol-1
②N2H4(g)+O2(g)===N2(g)+2H2O(g)ΔH2=-534 kJ·mol-1。
根据盖斯定律可知②—①×![]() 得:N2H4(g)+NO2(g)=
得:N2H4(g)+NO2(g)=![]() N2(g)+2H2O(g) ΔH=-567.85 kJ·mol-1。
N2(g)+2H2O(g) ΔH=-567.85 kJ·mol-1。

练习册系列答案
相关题目