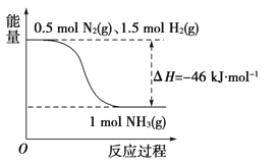
题目内容
【题目】K2Cr2O7溶液中存在平衡:Cr2O72-(橙色)+H2O![]() 2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:结合实验,下列说法不正确的是
2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:结合实验,下列说法不正确的是
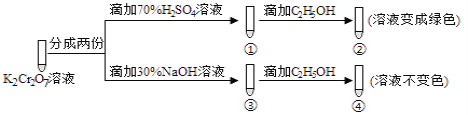
A. 若向④中加入70%H2SO4溶液至过量,溶液变为橙色
B. ②中C2H5OH被Cr2O72-氧化成CH3COOH
C. 对比②和④可知K2Cr2O7酸性溶液氧化性强
D. ①中溶液橙色加深,③中溶液变黄
【答案】A
【解析】
根据平衡移动原理分析平衡移动的反向,再根据题干所给信息分析实验现象。
若向④溶液中加入70%的硫酸到过量,溶液为酸性,平衡向逆方向移动,Cr2O72-可以氧化乙醇,溶液变绿色,故A错误;
②中C2H5OH被Cr2O72-氧化成CH3COOH,故B正确;
对比②和④可知K2Cr2O7酸性溶液氧化性强,故C正确;
滴加硫酸溶液时,平衡向左移动,Cr2O72-(橙色)浓度增大,橙色加深;滴加氢氧化钠溶液,平衡向右移动,CrO42-(黄色)浓度增大,溶液变黄,故D正确。

【题目】已知:转化率=某一反应物转化的量÷该反应物的初始量×100%。在一密闭容器中加入A、B、C三种气体,保持温度一定,在t1~t4时刻测得各物质的浓度如下表。据此判断下列结论不正确的是
测定时刻/s | t1 | t2 | t3 | t4 |
c(A)/(mol·L-1) | 6 | 3 | 2 | 2 |
c(B)/(mol·L-1) | 5 | 3.5 | 3 | 3 |
c(C)/(mol·L-1) | 1 | 2.5 | 3 | 3 |
A. 在t4时刻,该反应处于化学平衡状态
B. t3时,A的转化率比B的转化率高
C. t1至t2时刻,该反应的速率为3 mol·L-1 s-1
D. 该反应的化学方程式是:2A(g)+B(g)![]() C(g)
C(g)
【题目】某学习小组在实验室研究SO2与Ba(NO3)2溶液的反应。
实验:向盛有2mL 0.1mol/L Ba(NO3)2溶液的试管中,缓慢通入SO2气体,试管内有白色沉淀产生,液面上方略显浅棕色。
探究1:白色沉淀产生的原因。
(1)白色沉淀是_________(填化学式)。
(2)分析白色沉淀产生的原因,甲同学认为是NO3-氧化了SO2,乙同学认为是溶液中溶解的O2氧化了SO2。
①支持甲同学观点的实验证据是______________。
②乙同学通过下列实验证明了自己的推测正确,请完成实验方案:
实验操作 | 实验现象 |
向2mL___mol/L ___溶液(填化学式)中通入SO2 | ____________ |
探究2:在氧化SO2的过程中,NO3-和O2哪种微粒起到了主要作用。
实验操作 | 实验数据 |
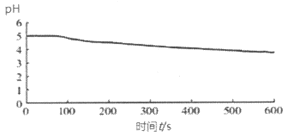
向烧杯中加入煮沸了的0.1 mol/L的BaCl2溶液25mL,再加入25mL植物油,冷却至室温,用pH传感器测定溶液pH随时间(t)的变化曲线 |
图1:向BaCl2 (无氧)溶液中通入SO2 |
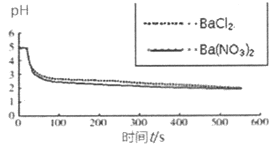
向烧杯中分别加入25mL 0.1 mol/L的BaCl2溶液、Ba(NO3)2溶液,通入SO2,用pH传感器分别测定溶液pH随时间(t)变化的曲线。 |
图2:分别向BaCl2、Ba(NO3)2溶液中通入SO2 |
(3)图1,在无氧条件下,向BaCl2溶液中持续通入SO2,溶液pH下降是因为_________(用方程式表示)。
(4)图2,BaCl2溶液中发生反应的离子方程式为___________。
(5)依据上述图像你得出的结论是_______________。