题目内容
【题目】根据下列叙述写出相应的热化学方程式:
(1)已知16 g固体硫完全燃烧时放出148.4 kJ的热量,写出表示硫的燃烧的热化学方程式_____________________________________。
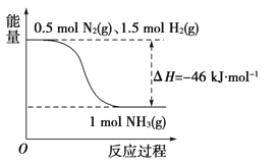
(2)如图是298 K、101 kPa时,N2与H2反应过程中能量变化的曲线图。该反应的热化学方程式为_______________________________。

【答案】S(s)+O2(g) ![]() SO2(g) ΔH=-296.8 kJ·mol-1N2(g)+3H2(g)
SO2(g) ΔH=-296.8 kJ·mol-1N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-92 kJ·mol-1
2NH3(g) ΔH=-92 kJ·mol-1
【解析】
(1)16g固体硫为0.5mol,完全燃烧时放出148.4kJ的热量,即1molS完全燃烧时放出放出296.8kJ热量;(2)图象分析可知是1molN2与和3molH2完全反应生成2molNH3,反应是放热反应,反应的焓变△H=508kJ/mol-600kJ/mol=-92kJ/mol,据此写出反应的热化学方程式。
(1)16g固体硫完全燃烧时放出148.4kJ的热量,即1molS完全燃烧时放出放出296.8kJ热量,则热化学方程式为:S(s)+O2(g)=SO2(g),△H=-296.8 kJ/mol;(2)图象分析可知,图象中表示的是1molN2与和3molH2氧气完全反应生成2molNH3,反应是放热反应,反应的焓变△H=508kJ/mol-600kJ/mol=-92kJ/mol,反应的热化学方程式为:N2(g)+3H2(g)2NH3(g)△H=-92 kJ/mol。

【题目】臭氧是理想的烟气脱硝剂,其脱硝反应为:2NO2(g)+O3(g)![]() N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
A | B | C | D |
|
|
|
|
升高温度, | 0~3s内,反应速率为: | t1时仅加入催化剂, | 达平衡时,仅改变x,则x为c(O2) |
【题目】请参考题中图表,已知E1=134 kJ·mol-1、E2=368 kJ·mol-1,根据要求回答问题:
(1)图Ⅰ是1 mol NO2(g)和1 mol CO(g)反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是__________(填“增大”、“减小”或“不变”,下同),ΔH的变化是__________。请写出NO2和CO反应的热化学方程式___________________。

(2)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应的热化学方程式如下:
①CH3OH(g)+H2O(g)==CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+![]() O2(g)==CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)==CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
且H2O(g)==H2O(l) ΔH=-44 kJ·mol-1,则甲醇蒸汽燃烧为液态水的热化学方程式为_______________。
(3)如表所示是部分化学键的键能参数:
化学键 | P—P | P—O | O===O | P===O |
键能/kJ·mol-1 | a | b | c | x |

已知白磷的燃烧热为d kJ·mol-1,白磷及其完全燃烧的产物的结构如图Ⅱ所示,则表中x=__________ kJ·mol-1(用含a、b、c、d的代表数式表示)。