题目内容
(14分)有两只密闭容器A和B,A能保持恒容,B能保持恒压。起始时向容积相等的A、B中分别通入等量的NH3气体,使之发生反应:2NH3(g) 3H2(g)+N2(g),并达到平衡。则:
3H2(g)+N2(g),并达到平衡。则:
(1)达到平衡所需要的时间:t(A) t(B),NH3的转化率:a(A) a(B) (填“>”、“=”或“<”)。
(2)反应过程中的反应速率:v(A) v(B) (填“>”、“=”或“<”)。
(3)达到平衡后,在两容器中分别通入等量的氦气。则B中的化学平衡向 反应方向移动,A中的化学反应速率 (填“增大”、“减小”或“不变”)。
(4)达到平衡后,向两容器中分别通入等量的原反应气体,再次达到平衡时,A容器中H2的百分含量 ,B容器中NH3的百分含量 (填“增大”、“减小”或“不变”)。
 3H2(g)+N2(g),并达到平衡。则:
3H2(g)+N2(g),并达到平衡。则:(1)达到平衡所需要的时间:t(A) t(B),NH3的转化率:a(A) a(B) (填“>”、“=”或“<”)。
(2)反应过程中的反应速率:v(A) v(B) (填“>”、“=”或“<”)。
(3)达到平衡后,在两容器中分别通入等量的氦气。则B中的化学平衡向 反应方向移动,A中的化学反应速率 (填“增大”、“减小”或“不变”)。
(4)达到平衡后,向两容器中分别通入等量的原反应气体,再次达到平衡时,A容器中H2的百分含量 ,B容器中NH3的百分含量 (填“增大”、“减小”或“不变”)。
(1)<,<(2)>(3)正,不变(4)减小,不变
试题分析:A容器相当于B容器加压,所以A容器的速率快v(A)> v(B),t(A) < t(B)。增大压强平衡逆向移动,所以NH3的转化率:a(A)< a(B)。达到平衡后,A容器中通入氦气,不影响任何与反应有关的物质的浓度,反应速率不变,B容器中通入氦气,体积增大,相当于减压,平衡正向移动。达到平衡后,向两容器中分别通入等量的原反应气体,A容器相当于加压,平衡逆向移动,H2的百分含量减小,B容器体积增大,但是平衡不移动,NH3的百分含量不变。
点评:本题解决的关键就是要找出A、B两容器如何建立等效。

练习册系列答案
相关题目
 H2(g)+I2(g)△H>0,H2的物质的量随时间的变化如图示,下列说法正确有是
H2(g)+I2(g)△H>0,H2的物质的量随时间的变化如图示,下列说法正确有是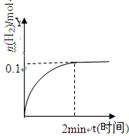

 2G(g)若开始时只充入2molG(g),达平衡时,混合气体的压强比起始时增加20%,若开始时只充入2molM和1molN的混合气体,达平衡时M的转化率为
2G(g)若开始时只充入2molG(g),达平衡时,混合气体的压强比起始时增加20%,若开始时只充入2molM和1molN的混合气体,达平衡时M的转化率为 NaCl(l)+ K(g)选取适宜的温度,使K成蒸汽从反应混合物中分离出来
NaCl(l)+ K(g)选取适宜的温度,使K成蒸汽从反应混合物中分离出来 Br2(g)+H2(g)在密闭容器中进行,将密闭容器的体积缩小至原来的一半,下列说法正确的是( )
Br2(g)+H2(g)在密闭容器中进行,将密闭容器的体积缩小至原来的一半,下列说法正确的是( ) B(g)+C(s),达到化学平衡后,升高温度,容器内气体的密度增大,则下列叙述正确的是
B(g)+C(s),达到化学平衡后,升高温度,容器内气体的密度增大,则下列叙述正确的是  2C(g),当平衡向正方向移动时,下列说法一定正确的是
2C(g),当平衡向正方向移动时,下列说法一定正确的是