题目内容
下列叙述不正确的是( )
A.用电子式表示HCl的形成过程: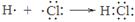 |
B.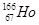 中的原子核内的中子数与核外电子数之差是99 中的原子核内的中子数与核外电子数之差是99 |
C.在空气中加热金属锂:4Li + O2 2Li2O 2Li2O |
D.铝热法炼铁:2Al + Fe2O3 2Fe+ Al2O3 2Fe+ Al2O3 |
B
解析考点分析:B项原子核内大中子数为166-67=99,与核外电子数之差为99-67=32.
考点:化学用语、化学反应方程式。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
对于相同物质的量的SO2和SO3,下列说法中正确的是
| A.硫元素的质量比为5∶4 | B.分子数之比为1∶1 |
| C.原子总数之比为4∶3 | D.质量之比为1∶1 |
阿佛加德罗常数用NA表示,下列叙述正确的是( )
| A.室温时,1L pH=2的NH4Cl溶液中水电离出10-12 molH+ |
| B.常温常压下,46g NO2含有的原子数小于3NA |
| C.12g石墨含有4NA个自由移动的电子 |
| D.1mol LiAlH4在125℃完全分解成LiH、H2、Al,转移电子3NA |
用NA表示阿伏德罗常数,下列叙述正确的是
| A.标准状况下,22.4LH2O含有的分子数为1 NA |
| B.1.06g Na2CO3含有的Na+为0.02 NA |
| C.NA个CO2分子占有的体积为22.4L |
| D.物质的量浓度为0.5mol·/L的MgCl2溶液中,含有Cl- 1 NA |
下列有关化学用语表示正确的是
A.N2的电子式: |
B.S2-的结构示意图: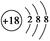 |
C.质子数为53,中子数为78的碘原子: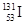 |
| D.乙烯的分子式: CH2=CH2 |
设NA为阿伏伽德罗常数的值。下列说法正确的是
| A.在密闭容器中加入l.5mol H2和0.5molN2,充分反应后可得到NH3分子数为NA |
| B.常温常压下,18g H2O含有的原子总数为3NA |
| C.1.0L的0.1 mol·L-1Na2S溶液中含有的S2-离子数为0.1NA |
| D.2SO2(g)+O2(g)=2SO3(g)和4SO2(g)+2O2(g)=4SO3(g)的△H相等 |
下列化学用语正确的是
A.NH4Cl的电子式: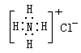 |
B.S2—的结构示意图: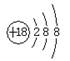 |
| C.乙醇的分子式:CH3CH2OH |
D.原子核内有8个中子的碳原子: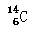 |
NA为阿伏加德罗常数,下列各项叙述中,正确的有
①0.2 mol H2O2完全分解转移的电子数为0.4NA
②25 ℃、101 kPa下,16 g O3和O2混合气体中含有的氧原子数为NA
③0.1 mol FeCl3滴入沸水形成的胶体粒子的数目为0.1 NA
④1 mol N2和3 mol H2在一定条件下的密闭容器中充分反应,容器内的分子数大于2NA
| A.①②③ | B.①②④ | C.①②③④ | D.②④ |
食盐、蔗糖、醋酸、纯碱、汽油、“84消毒液”等是日常生活中经常使用的物质,下列有关说法或表示正确的是
A.食盐中阴离子的核外电子排布结构示意图为: |
| B.纯碱与汽油去除油污的原理相同 |
C.“84消毒液”中有效成分NaClO的电子式为: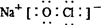 |
| D.蔗糖与醋酸的最简式相同 |