题目内容
【题目】某废催化剂含58.2%的SiO2、21.0%的ZnO、4.50%的ZnS和12.8%的CuS及少量的Fe3O4。某同学用15.0 g该废催化剂为原料,回收锌和铜。采用的实验方案如下:
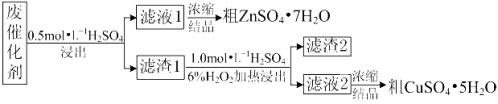
已知:① ZnS与稀硫酸反应时,化合价不变;
② CuS既不溶解于稀硫酸,也不与稀硫酸反应。
回答下列问题:
(1)在下列装置中,第一次浸出必须用________________,第二次浸出应选用______________。(填标号)。第二次浸出时,加热温度不宜过高的原因是 。

(2)滤液1中含有Fe2+,请根据提供的试剂进行检验,则检验方法为: 。
(提供的试剂:稀盐酸、KSCN溶液、KMnO4溶液、NaOH溶液、碘水)
(3)将滤液1、滤液2蒸发浓缩至 时,停止加热,然后冷却结晶得到相应的粗产品。
(4)若滤渣2中含有淡黄色固体,写出第二次浸出的化学反应方程式: 。
(5)某同学在实验完成之后,得到1.50 g CuSO4·5H2O,则铜的回收率为___________________。
【答案】(1)D(1分) A(1分) 温度过高H2O2易分解(1分)
(2)取少量滤液1,滴加高锰酸钾溶液,若褪色,则证明有Fe2+。(2分)
(3)溶液表面出现一层晶膜(1分)
(4)CuS+ H2O2+ H2SO4= ![]() CuSO4 +S+ 2H2O(2分)
CuSO4 +S+ 2H2O(2分)
(5)30.0%(2分)
【解析】
试题分析:(1)根据题目化学工艺流程知,第一次浸出发生反应ZnO+H2SO4=ZnSO4+H2O、ZnS+H2SO4=ZnSO4+H2S↑,Fe3O4+4H2SO4=FeSO4+Fe2(SO4)3+4H2O,有有毒气体生成,必须用氢氧化钠溶液进行尾气处理,选D装置,第二次浸出时发生反应:CuS++H2O2+ H2SO4=CuSO4+S+2H2O,不产生有毒气体,可以选用A装置;温度过高H2O2易分解,所以加热温度不宜过高。
(2)滤液1中含有Fe3+、Fe2+,加入的试剂只能与Fe2+反应,所以检验滤液1中含有Fe2+方法为取少量滤液1,滴加高锰酸钾溶液,若褪色,则证明有Fe2+。
(3)由电解质溶液获得结晶水合物的方法为蒸发浓缩、冷却结晶、过滤、洗涤、干燥,则将滤液1、滤液2蒸发浓缩至溶液表面出现一层晶膜时,停止加热,然后冷却结晶得到相应的粗产品。
(4)废催化剂中加入稀硫酸,SiO2和CuS与稀硫酸不反应,所以滤渣1中有SiO2和CuS,淡黄色固体是硫,所以CuS与H2O2和硫酸反应生成硫酸铜、S和水,反应的化学方程式为CuS+ H2O2+ H2SO4= ![]() CuSO4 +S+ 2H2O。
CuSO4 +S+ 2H2O。
(5)废催化剂中Cu的物质的量为15.0g×12.8%÷96g/mol=0.02mol,1.5g CuSO45H2O中Cu的物质含量的为1.5g÷250g/mol=0.006mol,则铜的回收率为0.006mol÷0.02mol×100%=30%。

 53天天练系列答案
53天天练系列答案