题目内容
【题目】(Ⅰ)已知氯水有漂白性,是因为含有 (化学式),能与AgNO3反应生成 色沉淀,是因为含有 (名称)离子;
(Ⅱ)在下图所示的物质转化关系中,A是常见的气态氢化物,其水溶液呈碱性,B是能使带火星的木条复燃的无色无味气体, G是一种红色金属单质。(部分反应中生成物没有全部列出,反应条件未列出)
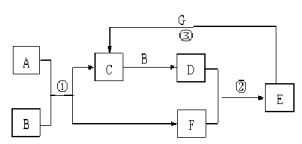
请回答下列问题:
(1)实验室制取A的化学方程式
(2)反应①的化学方程式为 。当有1molA参加反应时,转移 mol电子。
(3)反应②的化学方程式为 。
(4)反应③的离子方程式为
【答案】(Ⅰ)HClO;白;氯
(Ⅱ)(1)2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
(2)4NH3 + 5O2![]() 4NO + 6H2O;5
4NO + 6H2O;5
(3)3NO2+H2O=2HNO3+NO
(4)3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
【解析】
试题分析:(Ⅰ)已知氯水中存在化学反应:Cl2+H2OH++Cl-+HClO,其中HClO具有强氧化性,能将有色物质氧化成无色物质,因而有漂白性;氯离子(Cl-)能与AgNO3反应生成白色AgCl沉淀。
故答案为:HClO;白;氯;
(Ⅱ)B能使带火星的木条复燃的无色无味气体,则B是氧气;G是一种红色金属单质,则G是铜;A是常见的气态氢化物,其水溶液呈碱性,则A为NH3;NH3能与氧气反应生成C与F,C能与氧气反应生成D,则C为NO、F是水、D为NO2;D与水反应得到E,E能与Cu反应得到C,则E为2HNO3。
(1)由上述分析可知,A为NH3,实验室制取氨气的化学方程式为:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O。
CaCl2+2NH3↑+2H2O。
故答案为:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;
(2)由上述分析可知,反应①的化学方程式为4NH3 + 5O2![]() 4NO + 6H2O;由方程式可知,当有当
4NO + 6H2O;由方程式可知,当有当
有4mol氨气参加反应时,转移20mol电子,则当有1mol氨气参加反应时,转移5mol电子。
故答案为:4NH3 + 5O2![]() 4NO + 6H2O;5;
4NO + 6H2O;5;
(3)反应②为二氧化氮与水反应生成硝酸和NO,该反应的化学方程式为:3NO2+H2O=2HNO3+NO。
故答案为:3NO2+H2O=2HNO3+NO;
(4)反应③为铜和稀硝酸的反应,该反应的离子方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O。
故答案为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O。

【题目】某溶液只含下表离子中的几种,且各离子的物质的量浓度相等(不考虑水的电离与离子水解)。
阳离子 | K+、NH4+、Fe2+、Mg2+、Cu2+ |
阴离子 | OH-、Cl-、CO32-、SO42- |
某同学进行了如下实验(必要时可加热):

下列说法正确的是
A. 由沉淀A推断原溶液中一定含有SO42-
B. 原溶液中只含有NH4+、Fe2+、Cl-、SO42-
C. 滤液A中可能含有K+
D. 沉淀B中一定含有Mg(OH)2