题目内容
【题目】图表示的是往某Na2CO3溶液中滴入稀盐酸产生CO2气体的过程。
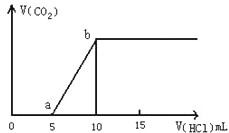
(1)写出a点以前发生反应的离子方程式: 。
(2)写出a点到b点发生反应的离子方程式: 。
(3)若某Na2CO3溶液中含m mol Na2CO3,向其中滴入一定量的稀盐酸,恰好使溶液中Cl-和HCO3-的物质的量之比为2:1,则滴入稀盐酸的物质的量等于 mol(用m表示)。
【答案】(1)CO32-+H+=HCO3-;(2)HCO3-+H+=H2O+CO2↑;(3)![]()
【解析】
试题分析:(1)碳酸钠和少量的盐酸之间反应生成的是碳酸氢钠和氯化钠,即Na2CO3+HCl=NaCl+NaHCO3,离子方程式为CO32-+H+=HCO3-,故答案为:CO32-+H+=HCO3-;
(2)碳酸氢钠和盐酸反应生成的是氯化钠、水以及二氧化碳,实质是:HCO3-+H+=H2O+CO2↑,故答案为:HCO3-+H+=H2O+CO2↑;
(3)设和碳酸氢钠反应的盐酸的物质的量是x,
Na2CO3+HCl=NaCl+NaHCO3
1 1 1 1
m m m m
NaHCO3+HCl=NaCl+H2O+CO2↑
1 1 1
x x x
则Cl-的物质的量为:m+x,HCO3-的物质的量为:m-x,使Cl-和HCO3-的物质的量比是2:1,即![]() =
=![]() ,解得x=
,解得x=![]() mol,加入盐酸的物质的量=
mol,加入盐酸的物质的量=![]() mol+mmol=
mol+mmol=![]() mol,故答案为:
mol,故答案为:![]() mol。
mol。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】某溶液只含下表离子中的几种,且各离子的物质的量浓度相等(不考虑水的电离与离子水解)。
阳离子 | K+、NH4+、Fe2+、Mg2+、Cu2+ |
阴离子 | OH-、Cl-、CO32-、SO42- |
某同学进行了如下实验(必要时可加热):

下列说法正确的是
A. 由沉淀A推断原溶液中一定含有SO42-
B. 原溶液中只含有NH4+、Fe2+、Cl-、SO42-
C. 滤液A中可能含有K+
D. 沉淀B中一定含有Mg(OH)2