题目内容
3.含3.01×1023个CO2分子的二氧化碳在标准状况下的体积约为11.2L,标准状况下33.6L氯化氢中含有9.03×1023个HCl分子.分析 根据n=$\frac{N}{{N}_{A}}$计算二氧化碳物质的量,再根据V=nVm计算二氧化碳的体积;
根据n=$\frac{V}{{V}_{m}}$计算HCl的物质的量,再根据N=nNA计算HCl分子数目.
解答 解:3.01×1023个CO2分子的物质的量为$\frac{3.01×1{0}^{23}}{6.02×1{0}^{23}mo{l}^{-1}}$=0.5mol,故二氧化碳在标准状况下的体积约为0.5mol×22.4L/mol=11.2L;
标准状况下33.6L氯化氢的物质的量为$\frac{33.6L}{22.4L/mol}$=1.5mol,含有HCl分子数目为1.5mol×6.02×1023mol-1=9.03×1023,
故答案为:11.2;9.03×1023.
点评 本题考查物质的量有关计算,比较基础,注意掌握以物质的量为中心的有关计算.

练习册系列答案
相关题目
7.利用下列实验装置图进行的相应实验,能达到实验目的是( )
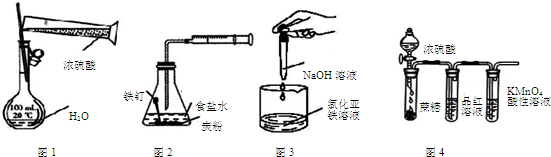

| A. | 用图1装置配制一定物质的量浓度的稀硫酸 | |
| B. | 用图2装置可探究铁的吸氧腐蚀 | |
| C. | 用图3装置可制取氢氧化亚铁 | |
| D. | 用图4装置可说明浓硫酸具有脱水性、强氧化性,SO2具有漂白性、氧化性 |
 实验室中配制碘水,往往是将I2溶于KI溶液中,这样就可以得到浓度较大的碘水,主要是因为发生了反应:I2(aq)+I-?I3-,上述平衡体系中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上的任意一点都表示平衡状态).
实验室中配制碘水,往往是将I2溶于KI溶液中,这样就可以得到浓度较大的碘水,主要是因为发生了反应:I2(aq)+I-?I3-,上述平衡体系中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上的任意一点都表示平衡状态).
 .
.