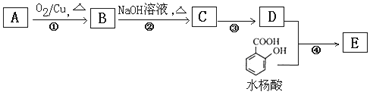
题目内容
【题目】25℃时,用浓度为0.1000mol/L的NaOH溶液滴定20.00mL 浓度均为0.1000mol/L 的三种酸HX、HY、HZ,滴定曲线如图所示。下列说法不正确的是
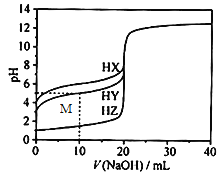
A. 该滴定过程能选择酚酞作为指示剂
B. HZ是强酸
C. HX消耗NaOH溶液20.00mL时,溶液pH>7
D. M 点处的溶液中c(Na+)>c(Y-)>c(H+)>c(OH-)
【答案】D
【解析】A.根据图象可知,0.1000mol/L 的三种酸HX、HY、HZ,在滴定前的pH分别为4、3、1,说明HX和HY在溶液中不能完全电离,属于弱酸,HZ在溶液中完全电离,属于强酸,在滴定终点时,HX和HY形成的NaX和NaY是强碱弱酸盐,溶液显碱性,因酚酞的变色范围是8-10,所以应选择酚酞作指示剂,HZ形成的NaZ是强碱强酸盐,可以选择甲基橙或酚酞作指示剂,故A正确;B.根据上述分析可知,HZ是强酸,故B正确;C.因HX和NaOH溶液的浓度相同,则消耗NaOH溶液20.00mL时,二者体积也相同,说明二者恰好完全反应得到NaX的盐溶液,因HX是弱酸,NaOH是强碱,所以NaX溶液显碱性,pH>7,故C正确;D.在M点处,NaOH溶液的体积是10.00mL,根据NaOH+HY=NaY+H2O可知,反应后HY剩余0.001mol,生成NaY0.001mol,此时溶液的pH=5,说明溶液显酸性,则HY的电离程度大于Y-的水解程度,溶液中离子浓度的大小关系是:c(Y-)>c(Na+)>c(H+)>c(OH-),故D错误;故答案选D。

练习册系列答案
相关题目