��Ŀ����
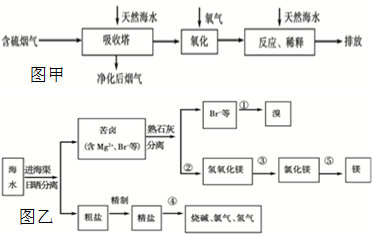
�Ӻ�ˮ����ȡþ������������þ����Ҫ��Դ����������ȡþ�Ĺ������漰�ļ������ʵ��ܶȻ�����������ѧ��֪ʶ�ش����м������⣺
��1���ڴӺ�ˮ����ȡþʱ�������õ����ǣ���Ҫ�ɷ���̼��ƣ�������Ϊ______����ܡ����ܡ�����������ĥ�ɷ�ĩֱ��Ͷ�뺣ˮ�У�������______���������ֱ��Ͷ�룬Ӧ���������δ�������д����ѧ����ʽ______��
��2��ijͬѧ��ʵ����������ģ����������̣���ʵ������ʯ�ң����������ռ���棬����Ϊ______
______������ԡ������ԡ����õ�Mg��OH��2���ڼ��Լ�ʱ��������Һ���뺣ˮ�У���˼����һ�£����ڵõ��Ļ����ϵ�м���������ռ���Һ���������______����ܡ����ܡ�����Mg2+ת��ΪMg��OH��2������������______���������ӷ���ʽ��ʾ��
��3����֪��ˮ��þ����Ũ��Ϊ1.8��10-3mol/L����Ҫʹþ���Ӳ�����������Һ��PH���ӦΪ______��
| ���� | CaCO3 | MgCO3 | Ca��OH��2 | Mg��OH��2 |
| �ܶȻ� | 2.8��10-9 | 6.8��10-6 | 5.5��10-6 | 1.8��10-11 |
��2��ijͬѧ��ʵ����������ģ����������̣���ʵ������ʯ�ң����������ռ���棬����Ϊ______
______������ԡ������ԡ����õ�Mg��OH��2���ڼ��Լ�ʱ��������Һ���뺣ˮ�У���˼����һ�£����ڵõ��Ļ����ϵ�м���������ռ���Һ���������______����ܡ����ܡ�����Mg2+ת��ΪMg��OH��2������������______���������ӷ���ʽ��ʾ��
��3����֪��ˮ��þ����Ũ��Ϊ1.8��10-3mol/L����Ҫʹþ���Ӳ�����������Һ��PH���ӦΪ______��
��1����֪���ǣ���Ҫ�ɷ���CaCO3����������ˮ�����ұ�MgCO3��Ҫ���ܣ����Խ�CaCO3��ֱ��Ͷ�뺣ˮ�в��ܲ���MgCO3����CaCO3ת��ΪCaO���䷴Ӧ����ʽΪ��CaCO3
CaO+CO2����CaO����ˮ��Ӧ���ɼ
�ʴ�Ϊ�����ܣ�������ĥ�ɷ�ĩ����CaCO3������CaCO3��MgCO3��Ҫ���ܣ����Խ���ֱ��Ͷ�뺣ˮ�в��ܲ���MgCO3��CaCO3
CaO+CO2����
��2��ģ����������̣���ʵ������ʯ�ң����ռ�Ҳ���Գ���þ���ӣ�Mg2++2OH-=Mg��OH��2������������Ǵ���̼���ƣ����Է�Ӧ��������ˮ��̼��þ���������Ļ����ϵ�м���������ռ���Һ��������þ�ܽ��С��̼��þ��ʵ�ֳ���ת������������þ�����������з�Ӧ�����ӷ���ʽΪ��Mg2++CO32-=MgCO3 MgCO3+2OH-=Mg��OH��2+CO32-��
�ʴ�Ϊ�����ԣ��ܣ�Mg2++CO32-=MgCO3 MgCO3+2OH-=Mg��OH��2+CO32-��
��3����֪ij�غ�ˮ�е�þ���ӵ�Ũ��Ϊ1.8��10-3 mol?L-1����c2��OH-��=
��c��OH-��=
=1.0��10-4 mol?L-1��
��c��H+��=1.0��10-10 mol?L-1������pH=10��
�ʴ�Ϊ��10��
| ||
�ʴ�Ϊ�����ܣ�������ĥ�ɷ�ĩ����CaCO3������CaCO3��MgCO3��Ҫ���ܣ����Խ���ֱ��Ͷ�뺣ˮ�в��ܲ���MgCO3��CaCO3
| ||
��2��ģ����������̣���ʵ������ʯ�ң����ռ�Ҳ���Գ���þ���ӣ�Mg2++2OH-=Mg��OH��2������������Ǵ���̼���ƣ����Է�Ӧ��������ˮ��̼��þ���������Ļ����ϵ�м���������ռ���Һ��������þ�ܽ��С��̼��þ��ʵ�ֳ���ת������������þ�����������з�Ӧ�����ӷ���ʽΪ��Mg2++CO32-=MgCO3 MgCO3+2OH-=Mg��OH��2+CO32-��
�ʴ�Ϊ�����ԣ��ܣ�Mg2++CO32-=MgCO3 MgCO3+2OH-=Mg��OH��2+CO32-��
��3����֪ij�غ�ˮ�е�þ���ӵ�Ũ��Ϊ1.8��10-3 mol?L-1����c2��OH-��=
| Ksp[Mg(OH)2] |
| c(Mg2+) |
|
��c��H+��=1.0��10-10 mol?L-1������pH=10��
�ʴ�Ϊ��10��

��ϰ��ϵ�д�
�����Ŀ