题目内容
【题目】下列模型分别表示C2H2、S8、SF6的结构,下列说法错误的是( )
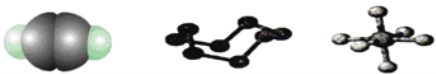
A. 32 g S8分子中含有0.125 mol σ键
B. SF6是由极性键构成的分子
C. 1 mol C2H2分子中有3 mol σ键和2 mol π键
D. S8中S的杂化方式为sp3杂化
【答案】A
【解析】
A.由分子结构可知1个S8分子中含有8个σ键;
B.以极性键结合的多原子分子如结构对称,正负电荷的中心重合,则为非极性分子;
C.C2H2的结构式为H﹣C≡C﹣H,单键为σ键,三键含有1个σ键、2个π键;
D.S8是一个环形分子,每个S与两个其它S原子相连,S原子外层6个电子,两对孤对电子,两上σ键,所以S是sp3杂化。
A.1个S8分子中含有8个σ键,则32g即0.125molS8分子中含有1molσ键,故A错误;B.SF6空间构型为对称结构,正负电荷的中心重合,为非极性分子,故B正确;
C.C2H2的结构式为H﹣C≡C﹣H,单键为σ键,三键含有1个σ键、2个π键,所以1molC2H2分子中有3molσ键和2molπ键,故C正确;
D.S8是一个环形分子,每个S与两个其它S原子相连,S原子外层6个电子,两对孤对电子,两上σ键,所以S是sp3杂化,故D正确。
故选A。

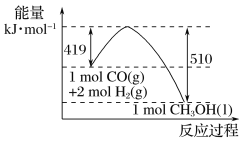
【题目】根据杂化轨道理论和价电子对互斥模型判断,下列分子或者离子的中心原子杂化方式及空间构型正确的是( )
选项 | 分子或离子 | 中心原子杂化方式 | 价电子对互斥模型 | 分子或离子的立体构型 |
A. | SO2 | sp | 直线形 | 直线形 |
B. | HCHO | sp2 | 平面三角形 | 三角锥形 |
C. | NF3 | sp2 | 四面体形 | 平面三角形 |
D. |
| sp3 | 正四面体形 | 正四面体形 |
A. AB. BC. CD. D
【题目】下表为元素周期表的一部分,请参照元素①—⑨在表中的位置,回答问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1)表中⑧元素单质可用作________。
(2)③、④、⑧的原子半径最小是________(用元素符号回答)。
(3)⑤、⑥、⑦的最高价氧化物对应的水化物中,碱性最强的是________(用化学式回答)。
(4)②、③、④的气态氢化物中,稳定性最弱的是________(用化学式回答)(5)②和③按原子数![]() 形成的化合物的电子式为________,该晶体气化的过程中克服的微粒间作用力为________。
形成的化合物的电子式为________,该晶体气化的过程中克服的微粒间作用力为________。
(6)③和⑧形成的化合物属于________(填“离子化合物”或“共价化合物”),该晶体属于________晶体(填“离子”、“分子”、“原子”)。
(7)元素⑤、⑦的最高价氧化物的水化物互相反应的化学方程式为:________________。