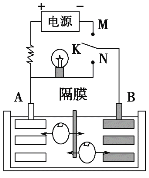
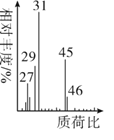
题目内容
【题目】下列的图示与对应的叙述不相符的是( )
A.图1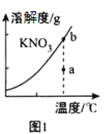 表示KNO3的溶解度曲线,图中a点表示的溶液通过恒温蒸发可以达到b点
表示KNO3的溶解度曲线,图中a点表示的溶液通过恒温蒸发可以达到b点
B.图2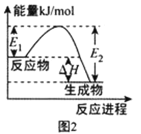 表示某一放热反应,若使用合适的催化剂,
表示某一放热反应,若使用合适的催化剂,![]() 、
、![]() 均减小,
均减小,![]() 不变
不变
C.图3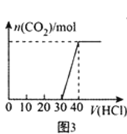 表示向Na2CO3和NaOH的混合溶液中滴加稀盐酸时,产生CO2的情况
表示向Na2CO3和NaOH的混合溶液中滴加稀盐酸时,产生CO2的情况
D.图4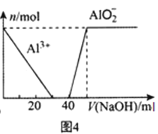 表示向100mL0.1mol/L的AlCl3和0.1mol/L的(NH4)2SO4混合溶液中滴加1mol/L的NaOH溶液时n(Al3+)和n(AlO2-)的变化情况
表示向100mL0.1mol/L的AlCl3和0.1mol/L的(NH4)2SO4混合溶液中滴加1mol/L的NaOH溶液时n(Al3+)和n(AlO2-)的变化情况
【答案】D
【解析】
A.溶解度曲线上的每一个点均对应饱和溶液,线下的每一个点均对应不饱和溶液,图中a、b点的温度相同,a点对应不饱和溶液,b点对应饱和溶液,所以a点的不饱和溶液可以通过恒温蒸发减少水分,使溶液饱和而达到b点,A项正确;
B.从图示可以看出,生成物的总能量小于反应物,所以该反应为放热反应;(正)催化剂可以减小正、逆反应的活化能(E1、E2),但并不影响整个反应的焓变,B项正确;
C.从图示可以看出,横坐标30至40mL段是发生反应:HCO3-+H+=H2O+CO2↑,所以在加入的前30mL盐酸中必然也有10mL发生反应:CO32-+H+=HCO3-,还有20mL盐酸用于中和NaOH:H++OH-=H2O,C项正确;
D.整个过程中先后发生3个反应。第1阶段形成Al(OH)3沉淀:Al3++3OH-=Al(OH)3↓,从量上看,n(Al3+)为0.01mol,消耗n(OH-)为0.03mol,图示此部分表达正确;第2阶段发生反应:NH4++OH-=NH3·H2O,从量上看,n(NH4+)为0.02mol,所以消耗n(OH-)为0.02mol,而图示是0.01mol,D项错误;
所以答案选择D项。

【题目】下列实验中,实验现象及结论都正确且两者具有因果关系的是
实验 | 现象 | 结论 | |
A | 向Ba(NO3)2溶液中通入二氧化硫气体 | 有白色沉淀生成 | SO2与Ba(NO3)2反应得到BaSO3 |
B | 向FeI2的溶液中滴加少量的氯水 | 溶液颜色变深 | Cl2与Fe2+反应生成Fe3+ |
C | 向蔗糖溶液中加几滴稀硫酸,水浴加热5min后,再加新制Cu(OH)2后加热 | 无砖红色沉淀生成 | 蔗糖没有水解 |
D | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体 | 溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
A. A B. B C. C D. D