题目内容
根据已知条件,对物质的性质强弱判断不正确的是( )
分析:A.反应能进行的主要原因是生成了气体CO分离出原体系;
B.元素非金属性强弱的判据可以从最高价氧化物对应水化物的酸性比较或气态氢化物的稳定性(与氢气化合的难易程度)来考虑;
C.根据强酸制弱酸的原理解题;
D.阳离子水解的程度越大,碱性越弱.
B.元素非金属性强弱的判据可以从最高价氧化物对应水化物的酸性比较或气态氢化物的稳定性(与氢气化合的难易程度)来考虑;
C.根据强酸制弱酸的原理解题;
D.阳离子水解的程度越大,碱性越弱.
解答:解:A.2C+SiO2
Si+2CO↑,反应能进行的主要原因是生成了气体CO分离出原体系,只能说明碳易与氧结合,故A错误;
B.根据气态氢化物的稳定性HA>HB,可知A的非金属性大于B,故还原性:A-<B-,故B正确;
C.则根据强酸制弱酸的原理,碳酸的酸性比苯酚强,故C正确;
D.根据c(M+)>c(N+)可以推出,至少N+是会水解的(M+也可能水解,但是它的水解程度比N+小),因为一种阳离子,它的对应碱的碱性越弱,这种离子的水解能力就越强,等浓度时,水解程度就越大,所以可以知道有以下两种可能:1、M+不水解,那么MOH就是强碱,N+会水解,NOH就是弱碱;2、M+也水解,但是它的水解程度比N+小,那么MOH就是碱性比NOH略强的弱碱.总之,都可以得出碱性:MOH>NOH,故D正确.
故选A.
| ||
B.根据气态氢化物的稳定性HA>HB,可知A的非金属性大于B,故还原性:A-<B-,故B正确;
C.则根据强酸制弱酸的原理,碳酸的酸性比苯酚强,故C正确;
D.根据c(M+)>c(N+)可以推出,至少N+是会水解的(M+也可能水解,但是它的水解程度比N+小),因为一种阳离子,它的对应碱的碱性越弱,这种离子的水解能力就越强,等浓度时,水解程度就越大,所以可以知道有以下两种可能:1、M+不水解,那么MOH就是强碱,N+会水解,NOH就是弱碱;2、M+也水解,但是它的水解程度比N+小,那么MOH就是碱性比NOH略强的弱碱.总之,都可以得出碱性:MOH>NOH,故D正确.
故选A.
点评:本题考查非金属性比较、强酸制弱酸原理、盐类的水解等,难度适中,注意一种阳离子,它的对应碱的碱性越弱,这种离子的水解能力就越强,等浓度时,水解程度就越大.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
根据已知条件,对物质的性质强弱判断不正确的是( )
| A、已知HF的共价键键能比HCl大,说明稳定性:HF>HCl | ||||
| B、已知正反应的活化能大于逆反应的活化能,说明总能量:生成物>反应物 | ||||
C、已知 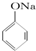 +SO2+H2O→ +SO2+H2O→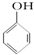 +Na2SO3,说明给出质子能力:HSO3->苯酚 +Na2SO3,说明给出质子能力:HSO3->苯酚 | ||||
D、已知CaCO3+SiO2
|


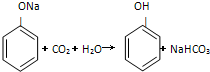
 Si+2CO↑,说明非金属性:碳>硅
Si+2CO↑,说明非金属性:碳>硅 ,说明酸性:碳酸>苯酚
,说明酸性:碳酸>苯酚