题目内容
对于Zn + H2SO4  ZnSO4 + H2 的化学反应(反应放热),下列叙述一定正确的是
ZnSO4 + H2 的化学反应(反应放热),下列叙述一定正确的是

 ZnSO4 + H2 的化学反应(反应放热),下列叙述一定正确的是
ZnSO4 + H2 的化学反应(反应放热),下列叙述一定正确的是
| A.1 mol锌的能量高于1 mol H2所含的能量 |
| B.若将该反应设计成原电池,锌为正极 |
| C.若将其设计为原电池,当有32.5 g锌溶解时,正极放出气体一定为11.2 L |
D.反应过程中能量关系可用右图表示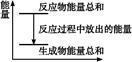 |
D
试题分析:该反应是放热反应,则反应物的总能量高于生成物的总能量,A不正确;在反应中锌失去电子,所以应该是负极,B不正确;C不正确,因为氢气不一定在标准状况下,所以正确的答案选D。
点评:该题是高考中的常见题型,属于中等难度的试题。试题基础性强,侧重对学生基础知识的巩固和训练,有利于提高学生的逻辑推理能力和应试能力。该题的关键是明确影响反应热大小的因素以及原电池的工作原理,然后灵活运用即可。

练习册系列答案
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案
相关题目
 C(g)+D(g)过程中的能量(kJ)变化如图所示,回答下列问题。
C(g)+D(g)过程中的能量(kJ)变化如图所示,回答下列问题。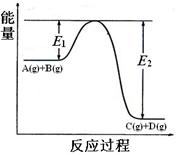
 2Z(正反应为放热反应),若升高温度则能使( )
2Z(正反应为放热反应),若升高温度则能使( )