题目内容
18.下列说法正确的是( )| A. | 书写热化学方程式时,只要在化学方程式的右端写上热量的符号和数值即可 | |
| B. | 凡是在加热或点燃条件下进行的反应都是吸热反应 | |
| C. | 氢气在氧气中燃烧的热化学方程式是2H2(g)+O2(g)═2H2O(l)△H=-483.6 kJ | |
| D. | 表明反应所放出或吸收热量的化学方程式叫做热化学方程式 |
分析 A.书写热化学方程式时,要在化学方程式的右端写上热量的符号和数值,还要注明各物质的状态;
B.有的放热反应也需要加热;
C.反应热的单位为kJ/mol;
D.根据热化学方程式的概念分析.
解答 解:A.书写热化学方程式时,要在化学方程式的右端写上热量的符号和数值,还要注明各物质的状态,故A错误;
B.有的放热反应也需要加热,所以在加热或点燃条件下进行的反应不一定是吸热反应,故B错误;
C.反应热的单位为kJ/mol,所以氢气在氧气中燃烧的热化学方程式是:2H2(g)+O2(g)═2H2O(l);△H=-483.6 kJ/mol,故 C错误;
D.热化学方程式的概念:表明反应所放出或吸收热量的化学方程式叫做热化学方程式,故D正确;
故选D.
点评 本题考查化学反应能量的变化,题目难度不大,注意先关概念的理解,学习中注意积累.

练习册系列答案
相关题目
4. 1.某废水中可能含有下列离子中的若干种:Fe3+、Al3+、Fe2+、Cu2+、Cl-、CO32-、NO3-、SO42-、SiO32-.现进行如下实验:
1.某废水中可能含有下列离子中的若干种:Fe3+、Al3+、Fe2+、Cu2+、Cl-、CO32-、NO3-、SO42-、SiO32-.现进行如下实验:
Ⅰ.取少量溶液,加入KSCN溶液,无明显变化
Ⅱ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色
Ⅲ.向Ⅱ中所得溶液中加入BaCl2溶液,有白色沉淀生成
Ⅳ.向Ⅱ中所得溶液中加入过量浓氨水,仅有红褪色沉淀生成,过滤,在所得溶液中加入盐酸至酸性时,再加入氢氧化钠溶液,有蓝色沉淀生成
请回答下列问题:
(1)该废水一定含有的离子是Fe2+、Cu2+、NO3-、SO42-;
(2)实验Ⅱ中加入盐酸生成无色气体的离子方程式是3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O;
(3)过滤除去Ⅳ中的蓝色沉淀,调整溶液的pH为10.7左右时,加入铝粉,反应产生氨气和氮气的体积比为1:4,其离子方程式为Al+NO3-+OH-AlO2-+NH3+N2+H2O(未配平).若除去0.2molNO3-,消耗铝9.6g.
2.某混合液中,可能大量含有的离子如表:
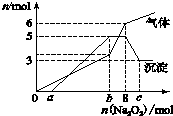
为探究其成分,某同学将Na2O2逐渐加入到上述混合溶液中并微热,产生沉淀和气体的物质的量与加入Na2O2的物质的量的关系分别如图所示:
(1)该溶液中一定含有的阳离子是H+、Al3+、NH4+、Mg2+,其对应物质的量浓度之比为2:2:2:3,溶液中一定不存在的阴离子是OH-、CO32-、AlO2-.
(2)请写出沉淀减少的离子方程式Al(OH)3+OH-═AlO2-+2H2O.
 1.某废水中可能含有下列离子中的若干种:Fe3+、Al3+、Fe2+、Cu2+、Cl-、CO32-、NO3-、SO42-、SiO32-.现进行如下实验:
1.某废水中可能含有下列离子中的若干种:Fe3+、Al3+、Fe2+、Cu2+、Cl-、CO32-、NO3-、SO42-、SiO32-.现进行如下实验:Ⅰ.取少量溶液,加入KSCN溶液,无明显变化
Ⅱ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色
Ⅲ.向Ⅱ中所得溶液中加入BaCl2溶液,有白色沉淀生成
Ⅳ.向Ⅱ中所得溶液中加入过量浓氨水,仅有红褪色沉淀生成,过滤,在所得溶液中加入盐酸至酸性时,再加入氢氧化钠溶液,有蓝色沉淀生成
请回答下列问题:
(1)该废水一定含有的离子是Fe2+、Cu2+、NO3-、SO42-;
(2)实验Ⅱ中加入盐酸生成无色气体的离子方程式是3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O;
(3)过滤除去Ⅳ中的蓝色沉淀,调整溶液的pH为10.7左右时,加入铝粉,反应产生氨气和氮气的体积比为1:4,其离子方程式为Al+NO3-+OH-AlO2-+NH3+N2+H2O(未配平).若除去0.2molNO3-,消耗铝9.6g.
2.某混合液中,可能大量含有的离子如表:
| 阳离子 | H+、K+、Al3+、NH4+、Mg2+ |
| 阴离子 | Cl-、Br-、OH-、CO32-、AlO2- |
(1)该溶液中一定含有的阳离子是H+、Al3+、NH4+、Mg2+,其对应物质的量浓度之比为2:2:2:3,溶液中一定不存在的阴离子是OH-、CO32-、AlO2-.
(2)请写出沉淀减少的离子方程式Al(OH)3+OH-═AlO2-+2H2O.
5.下表为元素周期表的一部分.请参照元素①一⑧在表中的位置.回答下列问题:(回答问题时,均需使用元素的真实元素符号,不得使用数字编号)
(1)②⑤⑥的原子半径由大到小的顺序为Na>Al>C.
(2)写出由①②两元素组成,且①的质量分数最高的分子的电子式为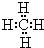 ,写出该化合物跟⑧的单质发生置换反应的化学方程式:CH4+2Cl2 $\frac{\underline{\;一定条件\;}}{\;}$C+4HCl.
,写出该化合物跟⑧的单质发生置换反应的化学方程式:CH4+2Cl2 $\frac{\underline{\;一定条件\;}}{\;}$C+4HCl.
(3)元素③的最高价氧化物可和元素⑤的氢氧化物水溶液发生反应,写出反应的离子方程式:N2O5+2OH-═2NO3-+H2O.
| 周期\族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅥⅠA | 0 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ |
(2)写出由①②两元素组成,且①的质量分数最高的分子的电子式为
 ,写出该化合物跟⑧的单质发生置换反应的化学方程式:CH4+2Cl2 $\frac{\underline{\;一定条件\;}}{\;}$C+4HCl.
,写出该化合物跟⑧的单质发生置换反应的化学方程式:CH4+2Cl2 $\frac{\underline{\;一定条件\;}}{\;}$C+4HCl.(3)元素③的最高价氧化物可和元素⑤的氢氧化物水溶液发生反应,写出反应的离子方程式:N2O5+2OH-═2NO3-+H2O.
6.相同温度下,容积均恒为2L的甲、乙、丙3个密闭容器中发生反应:2SO2(g)+O2(g)?2SO3(g)
△H=-197kJ•mol-l.实验测得起始、平衡时的有关数据如下表:
下列叙述正确的是( )
△H=-197kJ•mol-l.实验测得起始、平衡时的有关数据如下表:
| 容器 | 起始各物质的物质的量/mol | 达到平衡时体系能量的变化 | |||
| SO2 | O2 | SO2 | Ar | ||
| 甲 | 2 | 1 | 0 | 0 | 放出热量:Q1 |
| 乙 | 1.8 | 0.9 | 0.2 | 0 | 放出热量:Q2=78.8kJ |
| 丙 | 1.8 | 0.9 | 0.2 | 0.1 | 放出热量:Q2 |
| A. | Q1>Q3>Q2=78.8kJ | |
| B. | 三个容器中反应的平衡常数不相等 | |
| C. | 甲中反应达到平衡时,若升高温度,则SO2的转化率将大于50% | |
| D. | 若乙容器中的反应经tmin达到平衡,则0~tmin内,v(O2)=$\frac{1}{5t}$ mol/(L•min) |
13.下列关于热化学反应的描述中正确的是( )
| A. | 一个化学反应是否能在常温下发生与该反应的△H值的大小有必然联系 | |
| B. | 同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下进行的△H不相同 | |
| C. | 在一定条件下,某一化学反应是吸热反应还是放热反应,由生成物与反应物的焓值差决定 | |
| D. | 甲烷的燃烧热为890.3kJ•mol-1,则甲烷燃烧热的热化学方程式可表示为: CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ•mol-1 |
3.在下列各说法中,正确的是( )
| A. | 热化学方程式中的化学计量数表示物质的量,可以是分数 | |
| B. | △H>0表示放热反应,△H<0表示吸热反应 | |
| C. | 酸碱中和时放出的热叫做中和热 | |
| D. | 1mol H2与0.5 mol O2反应放出的热就是H2的燃烧热 |
8.已知EA、EB、EC、ED分别表示A、B、C、D所具有的能量,则对于放热反应A+B═C+D,以下说法正确的是( )
| A. | EA>EB | B. | EA>EC+ED | C. | EA+EB>EC+ED | D. | EA+EB<EC+ED |