题目内容
【题目】2017年11月16日,国土资源部召开新闻发布会,宣布天然气水合物,即“可燃冰”新矿种获得国务院批准,成为我国第173个矿种。“可燃冰”主要成分的分子式是CH4·8H2O,一旦温度升高或压强降低,甲烷气就会逸出,固体水合物便趋于崩解。“可燃冰”将成为人类的后续能源。
(1)将320 g可燃冰释放的甲烷完全燃烧生成液态水时,可放出1 780.6 kJ的能量,则表示甲烷燃烧热的热化学方程式是__________________。
(2)CH4不仅是优质的气体燃料,还能利用它和CO2重整,发生反应:CO2(g)+CH4(g)![]() 2CO(g)+2H2(g),获得合成气(主要成分为CO、H2),从而减少温室气体的排放。在一定条件下CH4的平衡转化率与温度及压强(单位:Pa)的关系如图所示。则y点:v(正)____(填“>”、“=”或“<”,下同)v(逆);压强:p1____p2;该反应的ΔH____0。
2CO(g)+2H2(g),获得合成气(主要成分为CO、H2),从而减少温室气体的排放。在一定条件下CH4的平衡转化率与温度及压强(单位:Pa)的关系如图所示。则y点:v(正)____(填“>”、“=”或“<”,下同)v(逆);压强:p1____p2;该反应的ΔH____0。
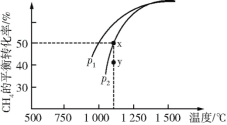
(3)在恒温、p2下,在一容积可变的容器中,达到平衡状态x时四种气体的物质的量均为1 mol,若此时再充入四种气体各1 mol,则平衡____(填“向左”、“向右”或“不”)移动。
(4)一定条件下,CH4还可与NO2反应,改善雾霾天气,其化学方程式为CH4(g)+2NO2(g)![]() CO2(g)+2H2O(g)+N2(g),在恒温恒容下,下列可以判断该反应达到平衡状态的是____(填序号)。
CO2(g)+2H2O(g)+N2(g),在恒温恒容下,下列可以判断该反应达到平衡状态的是____(填序号)。
a.v逆(N2)=2v正(H2O)
b.混合气体的密度不再变化
c.混合气体的物质的量不再变化
d.单位时间内有1 mol NO2消耗同时消耗1 mol CO2
e.混合气体的平均相对分子质量不变
f.CH4与CO2的物质的量之比不再发生变化
(5)在恒温恒容下,使1 mol CH4(g)与2 mol NO2反应,达平衡后,再往反应器中分别充入下列气体,可以使CH4(g)+2NO2(g)![]() CO2(g)+2H2O(g)+N2(g)中NO2转化率增大的是____(填序号)。
CO2(g)+2H2O(g)+N2(g)中NO2转化率增大的是____(填序号)。
A.CH4 B.CO2
C.物质的量之比为1∶2的CH4与NO2 D.N2
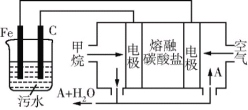
(6)CH4还可以运用到电化学中,某课外小组用CH4为燃料,空气为氧化剂,稀土金属材料作电极,电浮选凝聚法处理污水,设计如图所示装置。则甲烷 燃料电池的总反应式为______。为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环(如图),A物质的化学式是______。
【答案】CH4(g)+2O2(g)![]() CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1 > < > 不 cef A CH4+2O2
CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1 > < > 不 cef A CH4+2O2![]() CO2+2H2O CO2
CO2+2H2O CO2
【解析】
本题主要考查化学反应与能量变化以及化学平衡相关知识。
(1)320gCH4·8H2O可以释放出2molCH4,再根据燃烧热的定义解题;
(2)y点对应的甲烷转化率低于平衡时的转化率,反应应正向进行;该反应正向为气体体积增大的反应,减小压强,平衡正向移动,甲烷转化率增大;温度升高,甲烷转化率增大;
(3)恒温恒压条件下,同等增大各物质浓度,平衡不移动;
(4)依据“变量不变则平衡”原则判断化学反应是否达到平衡;
(5)根据“等效平衡”及勒夏特列原理判断;
(6)甲烷燃烧电池总反应为甲烷与氧气反应生成二氧化碳和水;根据电池正负极电极反应式判断需循环的物质。
(1)320g可燃冰可释放2mol甲烷,2mol甲烷完全燃烧放出1780.6kJ能量,则1mol甲烷完全燃烧放出890.3kJ能量,故甲烷燃烧热的热化学方程式为:CH4(g)+2O2(g)![]() CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1;
CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1;
(2)y点甲烷转化率低于平衡时甲烷转化率,故反应还需正向进行,故v(正)> v(逆);该反应正向为气体体积增大的反应,减小压强,平衡正向移动,由p1到p2,甲烷转化率降低,即增大了压强,故p1<p2;升高温度,甲烷转化率升高,升高温度,平衡向吸热方向移动,故该反应的ΔH>0;
(3)恒温恒压条件下,同等增大各物质浓度,平衡不移动;
(4)a. 平衡时,2v逆(N2)=v正(H2O),故a错误;
b.反应过程中,气体总质量不变,恒容条件下气体总体积不变,故气体密度始终不变,错误;
c.该反应反应过程中,混合气体的总物质的量不断发生改变,若混合气体的物质的量不再变化,则反应达到平衡,正确;
d.平衡时,单位时间内有2 mol NO2消耗同时消耗1 mol CO2,错误;
e.反应进行过程中,混合气体总物质的量发生改变,气体总质量不变,若混合气体的平均相对分子质量不变,则反应达到平衡状态,正确;
f.甲烷和二氧化碳属于可逆反应中不同反应方向的反应物,比值会随着反应的进行而改变,故当CH4与CO2的物质的量之比不再发生变化,反应达到平衡状态;
(5)A.增大甲烷物质的量,NO2的转化率增大,正确;B. CO2为生成物,增大CO2的量,平衡逆向移动,NO2的转化率减小,错误;C.通入物质的量之比为1∶2的CH4与NO2的混合气体,相当于压强增大,平衡逆向移动,NO2转化率降低,错误;D.N2为生成物,增大N2的浓度,平衡逆向移动,NO2转化率减小,错误。
(6)根据甲烷与氧气反应生成CO2和H2O写出该总反应式为:CH4+2O2![]() CO2+2H2O;该电池正极反应式为:
CO2+2H2O;该电池正极反应式为:![]() ,负极反应式为:
,负极反应式为:![]() ,由此可知,物质A为CO2。
,由此可知,物质A为CO2。