题目内容
【题目】氮和砷均为重要的无机材料,在化工领域具有广泛的应用。
(1)基态As原子的价层电子的电子云轮廓图形状为________。同一周期As、Ge、Se三种元素的第一电离能由大到小的顺序为________________。
(2)Na3AsO3中所含阴离子的立体构型为___________,写出一个与AsO33-具有相同空间构型和键合形式的分子____________________(填化学式)。
(3)在一定条件下NH3与CO2能合成尿素[CO(NH2)2],尿素中C原子和N原子轨道的杂化类型分别为__________,_________;1mol尿素分子中,![]() 键的数目为___________。
键的数目为___________。
(4)N2H4是火箭的燃料,与氧气的相对分子质量相同,它在常温常压下是液态,而氧气是气态,造成这种差异的主要原因是__________________。

(5)某砷镍合金的晶胞结构如图所示,阿伏加德罗常数的值为NA,则该晶体的密度![]() =________g·cm-3,该晶体中与每个Ni原子距离最近的As原子有_______个。
=________g·cm-3,该晶体中与每个Ni原子距离最近的As原子有_______个。
【答案】球形、哑铃形(或纺锤形) As>Se>Ge 三角锥形 PCl3、PBr3、NF3、NCl3等 sp2 sp3 7NA N2H4分子间除存在范德华力还存在氢键,O2分子间只有范德华力,氢键比范德华力强 ![]() 6
6
【解析】
本题考查了价层电子对互斥理论、氢键、晶体的相关计算等。
(1)基态As原子电子排布式为[Ar]3d104s24p3,价层电子为4s24p3,s轨道为球形,p轨道为哑铃形(或纺锤形);同周期时,自左往右元素的第一电离能总体趋势越来越大,因而Se大于Ge的第一电离能,同时As的4p轨道电子为半充满,因而较为稳定,其第一电离能大于邻近的Ge和Se,故同一周期As、Ge、Se三种元素的第一电离能由大到小的顺序为As>Se>Ge;
(2)Na3AsO3中所含阴离子为AsO33-,中心原子As的价层电子对数为3+1/2(5+3-3×2)=4,因而为sp3杂化,又As存在一对孤电子对,因而空间构型为三角锥形,与AsO33-具有相同空间构型和键合形式的分子很多,例如PCl3、PBr3、NF3、NCl3等;
(3)尿素[CO(NH2)2]的结构简式为![]() ,C原子形成3个σ键和1个π键,不存在孤对电子,因而C原子为sp2杂化,N原子形成3个σ键,且存在一个孤电子对,为sp3杂化,1分子尿素分子中有7个σ键,故1mol尿素分子中,
,C原子形成3个σ键和1个π键,不存在孤对电子,因而C原子为sp2杂化,N原子形成3个σ键,且存在一个孤电子对,为sp3杂化,1分子尿素分子中有7个σ键,故1mol尿素分子中,![]() 键的数目为7NA;
键的数目为7NA;
(4)N2H4与氧气都是分子晶体,一般其熔沸点和相对分子质量有关。虽然N2H4与氧气的相对分子质量相同,但还需考虑N2H4分子间除存在范德华力还存在氢键,O2分子间只有范德华力,氢键比范德华力强;
(5)晶胞内有2个As原子,Ni原子个数为2×![]() +4×
+4×![]() +2×
+2×![]() +4×
+4×![]() =2,因而晶胞内原子总质量m=
=2,因而晶胞内原子总质量m=![]() g,晶胞体积V=
g,晶胞体积V=![]() a2c×1030cm3,晶胞密度等于
a2c×1030cm3,晶胞密度等于![]() =
=![]() g·cm-3,晶胞是由两个完全相同的平行六面体上下推叠而成,例如下底最左边的Ni原子为六个这样的平行六面体所占有,每个这样的平行六面体含有1个As原子,因而该晶体中与每个Ni原子距离最近的As原子有6个。
g·cm-3,晶胞是由两个完全相同的平行六面体上下推叠而成,例如下底最左边的Ni原子为六个这样的平行六面体所占有,每个这样的平行六面体含有1个As原子,因而该晶体中与每个Ni原子距离最近的As原子有6个。

 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案【题目】以![]() 、软锰矿(主要成分为
、软锰矿(主要成分为![]() ,少量
,少量![]() 及
及![]() 的化合物等)、氨水及净化剂等为原料可制备
的化合物等)、氨水及净化剂等为原料可制备![]() 液和
液和![]() ,主要实验步骤如下
,主要实验步骤如下

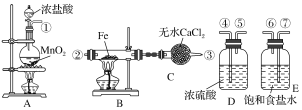
步骤I、如图所示装置,将![]() 通入
通入![]() 中的软锰矿浆液中
中的软锰矿浆液中![]() 。
。
步骤II、充分反应后,在不断搅拌下依次向仪器![]() 中加入适量纯净的
中加入适量纯净的![]() ,最后加入适量
,最后加入适量![]() 沉铅,
沉铅,
步骤III、过滤得![]() 溶液
溶液
(1)仪器R的名称是_______。
(2)装置![]() 用于制取
用于制取![]() ,反应的化学方程式为_________。
,反应的化学方程式为_________。
(3)装置![]() 中的反应应控制在90~100℃,适宜的加热方式是______________。
中的反应应控制在90~100℃,适宜的加热方式是______________。
(4)装置![]() 的作用是______________________。
的作用是______________________。
(5)“步骤Ⅱ”中加入纯净![]() 的目的是_______________,用
的目的是_______________,用![]() 调节溶液
调节溶液![]() 时,需调节溶液
时,需调节溶液![]() 的范围为________(该实验条件下,部分金属离子开始沉淀和沉淀完全的
的范围为________(该实验条件下,部分金属离子开始沉淀和沉淀完全的![]() 如下表)
如下表)
金属离子 |
|
|
|
|
开始沉淀的 | 7.04 | 1.87 | 3.32 | 7.56 |
沉淀完全的 | 9.18 | 3.27 | 4.9 | 10.2 |
(6)已知①用空气氧化![]() 浊液可制备
浊液可制备![]() ,主要副产物为
,主要副产物为![]() ;反应温度和溶液
;反应温度和溶液![]() 对产品中
对产品中![]() 的质量分数的影响分别如图所示
的质量分数的影响分别如图所示

②反应温度超过![]() 时,
时,![]() 的产率开始降低,
的产率开始降低,![]() 是白色沉淀,
是白色沉淀,![]() 呈黑色;
呈黑色;![]() 、
、![]() 中锰的质量分数理论值依次为72.05%、62.5%请补充完整由步骤III得到
中锰的质量分数理论值依次为72.05%、62.5%请补充完整由步骤III得到![]() 溶液,并用氨水等制备较纯净的
溶液,并用氨水等制备较纯净的![]() 的实验方案:______________________,真空干燥6小时得产品
的实验方案:______________________,真空干燥6小时得产品![]() 。
。
【题目】实验室需要0.1mol/LNaOH溶液450mL和0.5mol/L的硫酸溶液500mL。根据这两种溶液的配制情况回答下列问题。
(1)在下图所示仪器中,配制上述溶液肯定不需要的是_________(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是__________。

(2)在容量瓶的使用方法中,下列操作不正确的是____________
A.使用容量瓶前检验是否漏水 |
B.容量瓶用水洗净后,再用待配溶液洗涤 |
C.配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。 |
D.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。 |
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀。
(3)根据计算用托盘天平称取的质量为______g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度_____0.1mol/L(填“大于”“小于”或“等于”)。
(4)根据计算得知,需用量筒量取质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为_______mL,如果实验室有15mL、20mL、50mL量筒,应选用______mL量筒最好。