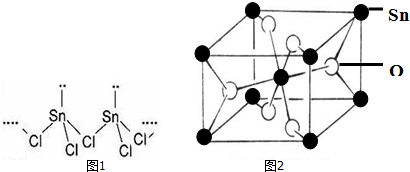
题目内容
3.下列实验操作正确的是( )| A. | 配制90mL1.00mol/L的NaCl溶液,用托盘天平称取5.3gNaCl固体 | |
| B. | 用蒸发方法使NaCl从溶液中析出时,应当坩埚中有大量固体析出时移走酒精灯用余热蒸干 | |
| C. | 先在天平两个托盘上各放一张相同质量的滤纸,再把氢氧化钠固体放在滤纸上称量 | |
| D. | 不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛 |
分析 A.没有90mL容量瓶,应配制100ml溶液;
B.蒸发应用蒸发皿;
C.氢氧化钠具有强腐蚀性,称量时应该放在小烧杯中快速称量;
D.应立即用水冲洗,边洗边眨眼睛,以最大程度减小对眼睛的危害.
解答 解:A.没有90mL容量瓶,应配制100ml溶液,应称取5.9g,故A错误;
B.蒸发应用蒸发皿,不能用坩埚,故B错误;
C.氢氧化钠具有腐蚀性,且容易潮解,所以在托盘天平上称量NaOH时,应将NaOH固体放在小烧杯中快速称量,故C错误;
D.不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛,以最大程度减小对眼睛的危害,故D正确.
故选D.
点评 本题考查了常见计量仪器及其使用方法、蒸发操作方法,题目难度不大,注意掌握常见计量仪器的构造及正确使用方法.

练习册系列答案
 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案
相关题目
15.25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )
| A. | pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| B. | 0.1mol•L-1 CH3COONa溶液与0.1mol•L-1 CH3COOH溶液等体积混合(pH=4.75):c(CH3COO-)+c(CH3COOH)=2c(Na+) | |
| C. | 0.1mol•L-1 CH3COONa溶液与0.1mol•L-1 HCl溶液混合至pH=7:c(Na+)>c(Cl-)=c(CH3COOH)>c(CH3COO-) | |
| D. | 0.1mol•L-1 Na2CO3溶液与0.1mol•L-1 NaHCO3溶液等体积混合:c(HCO3)+2c(H+)+3c(H2CO3)=c(CO32-)+2c(OH-) |
11.如图实验方案能达到实验目的是( )
| A. | 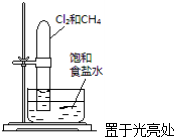 验证甲烷与氯气发生化学反应 | B. | 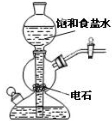 实验室制乙炔 | ||
| C. |  从碘与氯化钠的混合溶液中分离碘 | D. | 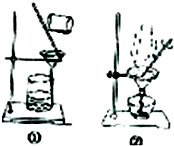 粗苯甲酸的提纯 |
18.对可逆反应A2(g)+B2(g)?2AB(g) 在一定条件下,达到平衡状态的标志是( )
| A. | 单位时间内生成2n mol AB的同时,生成n mol的B2 | |
| B. | 平衡时容器内的总压强不随时间而变化 | |
| C. | 平衡时容器内各物质的物质的量比为1:1:2 | |
| D. | 单位时间内,生成n mol A2的同时,生成n mol的B2 |
8.已知KMnO4在酸性溶液中已被还原成Mn2+,KMnO4、Cl2、Fe3+、I2的氧化性依次减弱.下列反应在水溶液中不可能发生的是( )
| A. | Cl2+FeI2═FeCl2+I2 | |
| B. | 2Fe3++2I-═2Fe2++I2 | |
| C. | 2KMnO4+16HCl═2MnCl2+5Cl2↑+2KCl+8H2O | |
| D. | 2FeCl3+4FeI3═3Cl2+6FeI2 |
15.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,22.4LNO与0.5molO2充分反应,最后得到NA个NO2分子 | |
| B. | 1.0L 0.5mol/L的NaAlO2水溶液中含有氧原子数为NA | |
| C. | 常温常压下,14g的C2H4和C4H8混合气体中含有的原子数为3NA | |
| D. | 某密闭容器盛有0.2molSO2和0.1molO2,在一定条件下充分反应,转移电子的数目为0.4NA |
13.实验中需1mol•L-1的Na2CO3溶液950mL,配制时应选用容量瓶的规格和称取Na2CO3的质量分别是( )
| A. | 1000 mL,106.0g | B. | 950 mL,100.7g | C. | 950 mL,106.0g | D. | 1000 mL,100.7 g |