题目内容
【题目】近年来,新能源开发和环境保护问题日益引起人们的重视,新型电池是科学家们非常重视的研究方向。用吸附了![]() 的碳纳米管等材料制作的二次电池的原理如图所示。下列说法正确的是( )
的碳纳米管等材料制作的二次电池的原理如图所示。下列说法正确的是( )
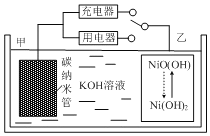
A.碳纳米管的作用只是吸附氢气
B.放电时,乙电极反应为![]()
C.充电时,电池的甲电极与直流电源的正极相连放电
D.电池总反应为H2+2NiO(OH)![]() 2Ni(OH)2
2Ni(OH)2
【答案】D
【解析】
放电时,甲电极中H2失电子作负极,则乙电极为正极,NiO(OH)得电子作正极;充电时,甲电极作阴极,与电源负极相连,乙电极作阳极与电源正极相连。
A.碳纳米管的作用除吸附氢气外,还充当电极材料,A不正确;
B.放电时,乙电极作正极,发生反应为NiO(OH)+e-+H2O=Ni(OH)2+OH-,B不正确;
C.充电时,电池的甲电极作阴极,与直流电源的负极相连,C不正确;
D.电池放电时,负极H2-2e-+2OH-=2H2O,正极2NiO(OH)+2e-+2H2O=2Ni(OH)2+2OH-,由此得出总反应为H2+2NiO(OH)![]() 2Ni(OH)2,D正确;
2Ni(OH)2,D正确;
故选D。

【题目】由下列实验及现象,推出的相应结论正确的是
实验 | 现象 | 结论 |
A.用铂丝蘸取某金属的盐溶液, 在酒精灯火焰上灼烧 | 火焰呈黄色 | 此盐溶液中含有 Na+,不含 K+ |
B.向饱和NaHCO3溶液中加入足量氯水 | 有无色气体产生 | 氯水中含HClO |
C.将足量SO2气体通入石蕊试液中 | 石蕊试液变红色 | SO2水溶液显酸性 |
D.向酸性KMnO4溶液中通入SO2 | 溶液紫色褪去 | SO2具有漂白性 |
A.AB.BC.CD.D
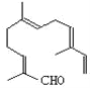
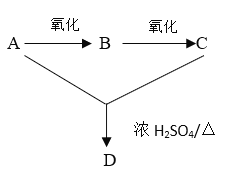
【题目】苯甲酸又称安息香酸(C6H5COOH),可用于合成纤维、树脂涂料等也可作为药物或防腐剂使用,有抑制真菌、细菌生长的作用。实验室中由甲苯制备苯甲酸的实验如下:
查阅资料:
①苯甲酸是一元有机弱酸不易被氧化。在水中溶解度:0.35g(25℃)、2.7g(80℃)、5.9g(100℃)。甲苯易溶于有机溶剂,不溶于水。
②
相对分子质量 | 熔点(℃) | 沸点(℃) | 密度(g·cm-3) | |
苯甲酸 | 122 | 122.4 | 249 | 1.3 |
甲苯 | 92 | -95 | 110.6 | 0.9 |
实验步骤:
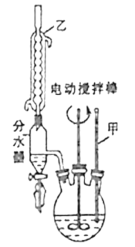
第一步:将9.2g甲苯和硫酸酸化的KMnO4溶液(过量)置于如图的三颈烧瓶中,加热保持反应物溶液温度在90℃左右至反应结束,主要反应为5C6H5CH3+6KMnO4+9H2SO4![]() 5C6H5COOH+3K2SO4+4MnSO4+14H2O,制备过程中不断从分水器分离出水;
5C6H5COOH+3K2SO4+4MnSO4+14H2O,制备过程中不断从分水器分离出水;
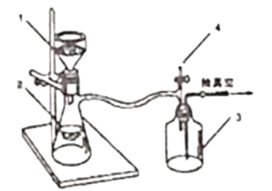
第二步:将反应后混合液趁热过滤滤液冷却后用硫酸酸化用如图装置抽滤得粗产品;(抽滤又称减压过滤利用抽气泵使抽滤瓶中的压强降低达到固液分离的目的。)
第三步:粗产品用水洗涤2到3次,干燥称量得固体![]() .
.
请回答下列问题:
(1)图1中装置乙的名称为___。
(2)分水器的作用是分离出水其主要目的是___,判断该反应进行完全的实验现象是___。
(3)实验第二步中,趁热过滤的原因是___,采用抽滤的优点是____。停止抽滤时先旋开图2中4处的旋塞恢复常压,然后关闭抽气泵,装置3起到的作用是____。
(4)第三步证明粗产品洗涤干净的方法是___。
(5)苯甲酸的产率为____。
(6)结合下列试剂和用品设计最简单实验验证苯甲酸是弱酸,具体操作为__。
0.010mol·L-1的苯甲酸溶液;0.010mol·L-1的苯甲酸钠溶液;0.010mol·L-1的氢氧化钠溶液;0.010mol·L-1的盐酸溶液;广泛pH试纸;甲基橙,酚酞(仪器任选)。