题目内容
5.(1)实验室中可用K35ClO3和浓H37Cl反应制取氯气,该反应的化学方程式为:K35ClO3+6H37Cl=K37Cl+3Cl2↑+3H2O;氧化产物是Cl2;还原产物是Cl2;氧化产物与还原产物物质的量之比是5:1;得到氯气的摩尔质量是73.3g/mol;产生71.00g的氯气电子转移数目为1.6NA(NA表示阿伏加德罗常数).
(2)化学镀镍的溶液中含有Ni2+和H2PO2-在酸性条件下发生如下反应,请配平该反应.
1Ni2++1H2PO2-+H2O→1Ni++1H2PO3-+2H+.
分析 (1)用K35ClO3和浓H37Cl反应制取氯气,反应的方程式为K35ClO3+6H37Cl=K37Cl+3Cl2↑+3H2O,K35ClO3中氯原子化合价降低做氧化剂生成还原产物,6H37Cl中有5H37Cl的氯原子化合价升高做还原剂生成氧化产物,再根据氯原子守恒,生成的Cl2中,35Cl与37Cl个数比为1:5,然后根据摩尔质量与相对分子质量在数值上相等,据此分析;
(2)根据氧化还原反应中化合价变化及质量守恒定律判断反应物和生成物,并配平反应方程式、判断还原产物.
解答 解:(1)用K35ClO3和浓H37Cl反应制取氯气,反应的方程式为K35ClO3+6H37Cl=K37Cl+3Cl2↑+3H2O,K35ClO3中氯原子化合价降低做氧化剂生成氯气为还原产物,6H37Cl中有5H37Cl的氯原子化合价升高做还原剂生成氯气为氧化产物,所以氧化产物与还原产物物质的量之比是5:1,再根据氯原子守恒,生成的Cl2中,35Cl与37Cl个数比为1:5,所以得到氯气的摩尔质量是$\frac{35×1+37×5}{3}$=73.3g/mol,又K35ClO3+6H37Cl=K37Cl+3Cl2↑+3H2O,反应生成3mol氯气转移5mol电子,所以产生71.00g的氯气电子转移数目为$\frac{71}{73.3}$×$\frac{5}{3}$=1.6mol即1.6NA,
故答案为:K35ClO3+6H37Cl=K37Cl+3Cl2↑+3H2O;Cl2;Cl2;5:1;73.3g/mol;1.6NA;
(2)由氧化还原反应中化合价升降相等进行配平:镍元素的化合价降低了2价,磷元素的化合价升高的2价,所以根据原子守恒结合电荷守恒可得配平的方程式为:H2O+Ni2++H2PO2-+═Ni+H2PO3-+2H+,
故答案为:1;1;H2O;1;1;2H+.
点评 本题考查了氧化还原反应,明确反应中元素的化合价变化及原子守恒为解答的关键,题目难度不大.

| A. | 二氧化碳可用于灭火 | |
| B. | 可用pH试纸测定溶液酸碱度 | |
| C. | 可用灼烧的方法鉴定羊毛、合成纤维 | |
| D. | 稀释浓硫酸时可将水倒入盛有浓硫酸的烧杯中 |
| A. | 可以用氯水鉴别AgNO3、Al2(SO4)3、CuSO4溶液 | |
| B. | 石油分馏可获得乙烯、丙烯和丁二烯 | |
| C. | 电解质在熔化状态下不一定能导电 | |
| D. | 用核磁共振氢谱可鉴定未知物C2H6O的分子结构 |
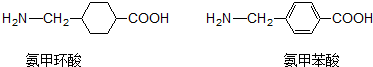
| A. | 氨甲环酸、氨甲苯酸都能发生取代、氧化、加聚、加成等反应 | |
| B. | 氨甲环酸、氨甲苯酸中都有5种不同的氢原子 | |
| C. | 氨甲环酸与氨甲苯酸互为同分异构体 | |
| D. | 氨甲环酸、氨甲苯酸都能与NaOH溶液反应 |
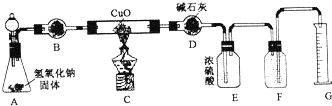
(1)按图设计组装好仪器,先检查装置的气密性,再装入药品.
(2)A中分液漏斗内应装浓氨水 B中固体试剂为碱石灰.
(3)打开分液漏斗活塞,加入试剂,点燃c处的酒精灯,一段时间后,观察到,A中氧化铜全部转化成光亮的红色固体,F中集气瓶内收集到一种无色气态单质.写出装置C中反应的化学方程式:2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3H2O
(4)E中浓硫酸的作用是吸收未反应的氨气..
(5)已知Cu2O也是红色的.表为实验前后C装置的质量,通过计算可知反应后的产物中有(填“有’’、“无’’、“无法确定”)Cu2O.
| 空玻璃管 | 实验前(样品+玻璃管) | 实验后(样品+玻璃管) |
| 59.60g | 65.60g | 64.64g |
| A. | 钠盐 | B. | 碱 | C. | 碳酸盐 | D. | 无机物 |
| A. | O2与O4属于同素异形体 | B. | H2与H4属于同位素 | ||
| C. | C60的质量数为 720 g/mol | D. | N5+中含有36个电子 |
