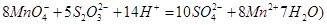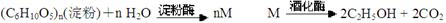题目内容
(8分)实验室以含有Mg2+、Cl—、Br—、SO42—等离子的卤水为主要原料制备Mg和Br2,流程如下:
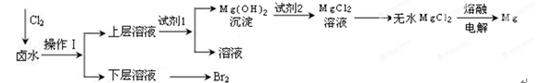
(1)操作Ⅰ使用的试剂是 ;所用主要仪器的名称是 。
(2)为了使Mg2+转化为沉淀,试剂1可以选用 ;加入试剂1后,能够分离得到Mg(OH)2沉淀的方法是 。
(3)试剂2可以选用 。
(4)请写出由无水MgCl2生成Mg的化学反应方程式 。

(1)操作Ⅰ使用的试剂是 ;所用主要仪器的名称是 。
(2)为了使Mg2+转化为沉淀,试剂1可以选用 ;加入试剂1后,能够分离得到Mg(OH)2沉淀的方法是 。
(3)试剂2可以选用 。
(4)请写出由无水MgCl2生成Mg的化学反应方程式 。
(1)CCl4 、分液漏斗(各1分) (2)NaOH(答案合理即可)、过滤(各1分)
(3)盐酸(2分) (4)MgCl2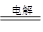 Mg+Cl2↑(2分)
Mg+Cl2↑(2分)
(3)盐酸(2分) (4)MgCl2
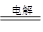 Mg+Cl2↑(2分)
Mg+Cl2↑(2分)(1)单质溴易溶在有机溶剂中,,所以要分离出溴,需要萃取。因为下层中含有单质溴,说明萃取剂的密度大于水的,因此选择四氯化碳。萃取后的分液需要分液漏斗。
(2)要使镁离子转化为氢氧化镁沉淀,加入氢氧化钠即可。氢氧化镁不溶于水,过滤即可。
(3)使氢氧化镁转化为氯化镁需要加入盐酸。
(4)镁是活泼的金属,通过电解冶炼,方程式为MgCl2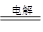 Mg+Cl2↑。
Mg+Cl2↑。
(2)要使镁离子转化为氢氧化镁沉淀,加入氢氧化钠即可。氢氧化镁不溶于水,过滤即可。
(3)使氢氧化镁转化为氯化镁需要加入盐酸。
(4)镁是活泼的金属,通过电解冶炼,方程式为MgCl2
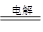 Mg+Cl2↑。
Mg+Cl2↑。
练习册系列答案
 优生乐园系列答案
优生乐园系列答案
相关题目
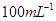 标准Na2S2O3溶液,需准确称取Na2S2O3固体的质量
标准Na2S2O3溶液,需准确称取Na2S2O3固体的质量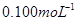 标准Na2S2O3溶液进行滴定,滴定至终点消耗Na2S2O3溶液12.00mL。计算该KMnO4产品的纯度。(有关离子方程式为:
标准Na2S2O3溶液进行滴定,滴定至终点消耗Na2S2O3溶液12.00mL。计算该KMnO4产品的纯度。(有关离子方程式为: