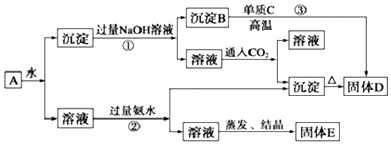
题目内容
9.下列物质的制备与工业生产实际相符的是( )| A. | N2$→_{放电}^{O_{2}}$NO2$\stackrel{H_{2}O}{→}$HNO3 | |
| B. | MnO2$→_{△}^{浓盐酸}$Cl2$\stackrel{石灰水}{→}$漂白粉 | |
| C. | 黄铁矿$→_{煅烧}^{沸腾炉}$SO2$→_{O_{2}}^{接触室}$SO3$→_{水}^{吸收塔}$稀硫酸 | |
| D. | 铝土矿$→_{过滤}^{NaOH溶液}$NaAlO2溶液$→_{过滤}^{CO_{2}}$Al(OH)3$\stackrel{△}{→}$Al2O3$\stackrel{电解}{→}$Al |
分析 A.工业用氨气催化氧化生成一氧化氮;
B.工业上常以食盐为原料制备氯气,氯气通入石灰乳制备漂白粉;
C.工业上用浓硫酸吸收三氧化硫;
D.从铝土矿中提取铝反应过程 ①溶解:将铝土矿溶于NaOH(aq):Al₂O₃+2NaOH=2NaAlO+H₂O ②过滤:除去残渣氧化亚铁(FeO)、硅铝酸钠等 ③酸化:向滤液中通入过量CO2,NaAlO2+CO₂+2H₂O=Al(OH)₃↓+NaHCO₃④过滤、灼烧 Al(OH)₃得到氧化铝,⑤电解熔融的氧化铝生成铝.
解答 解:A.工业用氨气催化氧化生成一氧化氮,一氧化氮氧化生成二氧化氮,二氧化氮与水反应生成硝酸,过程为:NH3 $\stackrel{O_{2}}{→}$NO $\stackrel{H_{2}O、O_{2}}{→}$HNO3,故A错误;
B.工业上制备漂白粉的工业流程:①NaCl溶液$\stackrel{通电}{→}$Cl2 $\stackrel{石灰乳}{→}$漂白粉,故B错误;
C.工业上用浓硫酸吸收三氧化硫,正确的流程为:黄铁矿$→_{煅烧}^{沸腾室}$SO2$\stackrel{接触室}{→}$SO3$\stackrel{98.3%的浓硫酸}{→}$稀硫酸,故C错误;
D.工业制铝流程为:铝土矿$→_{过滤}^{NaOH溶液}$NaAlO2溶液$→_{过滤}^{CO_{2}}$Al(OH)3$\stackrel{△}{→}$Al2O3$\stackrel{电解}{→}$Al,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,涉及工业制备物质的流程,熟悉反应原理是解题关键,注意相关知识的积累,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.下列说法不正确的是( )
| A. | 物质的量是用来研究微观粒子的一个国际基本物理量,其单位是摩尔 | |
| B. | 气体的摩尔体积与温度和压强有关,压强越大,体积越小 | |
| C. | 若x个N(氮)原子的质量是1克,则阿佛加德罗常数可表示为28xmol-1 | |
| D. | 任何一种微观粒子,当摩尔质量以g/mol为单位时,其数值与这种粒子的相对分子质量或相对原子质量相同 |
17.用NA表示阿伏加德罗常数的值,卞列叙述正确的是( )
| A. | 含有NA个原子的氢气在标准状况下的体积约为22.4L | |
| B. | 25℃,1.01×105Pa,64gS02中含有的原子数为3NA | |
| C. | 40gNaOH溶解在1L水中,则其100 mL溶液中含Na+数为0.1NA | |
| D. | 标准状况下,11.2 LH20含有的分子数为0.5NA |
4.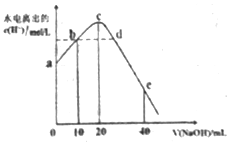 常温下,向20ml0.01mol•L-1CH3COOH溶液中逐滴加入0.01mol•L-1的NaOH溶液,溶液中水所电离出的c(H+)随加入NaOH溶液的体积变化示意图如图所示,下列说法不正确的是( )
常温下,向20ml0.01mol•L-1CH3COOH溶液中逐滴加入0.01mol•L-1的NaOH溶液,溶液中水所电离出的c(H+)随加入NaOH溶液的体积变化示意图如图所示,下列说法不正确的是( )
 常温下,向20ml0.01mol•L-1CH3COOH溶液中逐滴加入0.01mol•L-1的NaOH溶液,溶液中水所电离出的c(H+)随加入NaOH溶液的体积变化示意图如图所示,下列说法不正确的是( )
常温下,向20ml0.01mol•L-1CH3COOH溶液中逐滴加入0.01mol•L-1的NaOH溶液,溶液中水所电离出的c(H+)随加入NaOH溶液的体积变化示意图如图所示,下列说法不正确的是( )| A. | 从a到c,醋酸的电离始终受到促进 | |
| B. | 从b→c的过程中,既存在着pH=7的点,也存在着溶液中水所电离出的c(H+)=10-7的点 | |
| C. | b点:2c(Na+)=c(CH3COO-)+c(CH3COOH) | |
| D. | a、d对应的纵坐标数值分别是:>10-12、>10-7 |
14.下列实验操作中错误的是( )
| A. | 用四氯化碳萃取碘水中的碘的实验,分液时,水从分液漏斗下口流出,碘的四氯化碳溶液从上口倒出 | |
| B. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 | |
| C. | 蒸发结晶时剩余少量液体停止加热 | |
| D. | 称量时,称量物放在称量纸上置于托盘天平的左盘,砝码放在托盘天平的右盘中 |
1.高锰酸钾(KMnO4)是一种强氧化剂,在化学实验中被大量使用,下列关于它的性质和用途的叙述正确的是( )
| A. | 为了增强其氧化性,在配制时加入一定浓度的盐酸 | |
| B. | 该物质在反应中可以被还原,也可以被氧化 | |
| C. | 可用酸化的KMnO4溶液除去甲烷中的乙烯 | |
| D. | KMnO4中Mn元素为其最高价+7,故含有最高价元素的化合物,均有强氧化性,如浓硫酸、浓硝酸 |