题目内容
18.某混合物A含有Al2 (SO4)3、Al2O3和Fe2O3,在一定条件下可实现下列物质之间的变化: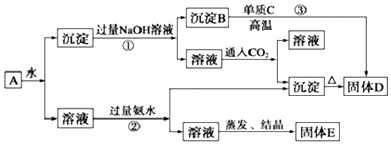
据此判断:
(1)固体E所含物质的化学式为K2SO4、(NH4)2SO4.
(2)反应③可用来焊接钢轨,化学方程式为2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3:该反应称为铝热反应.
(3)反应①的离子方程式为Al2O3+2OH-═2AlO2-+H2O.
(4)反应②的离子方程式为Al3++3NH3•H2O═Al(OH)3↓+3NH4+.
(5)实验室配制氯化亚铁溶液时是把氯化亚铁溶解于煮沸过的蒸馏水中,并加入盐酸和铁粉,向氯化亚铁溶液中加入氢氧化钠溶液时生成沉淀的颜色由白色迅速变为灰绿色,最后变为红褐色,反应的化学方程式是FeCl2+2NaOH=Fe(OH)2↓+2NaCl、4Fe(OH)2+O2+2H2O=4Fe(OH)3.
分析 KAl(SO4)2溶于水,Al2O3和Fe2O3均不溶于水,混合物A加水溶解后,溶液中是KAl(SO4)2,沉淀是Al2O3和Fe2O3;向沉淀中加NaOH溶液,Fe2O3不反应,Al2O3可与NaOH溶液反应生成NaAlO2,则B为Fe2O3,向NaAlO2溶液中通入CO2可得Al(OH)3沉淀,Al(OH)3受热分解生成Al2O3,则D为Al2O3,反应③为铝热反应,单质C为Al;向溶液中加过量氨水,溶液与过量氨水反应,Al3+被沉淀,得到氢氧化铝沉淀,溶液中剩余的是K2SO4 和(NH4)2SO4,经过蒸发、结晶,得到E中含K2SO4 和(NH4)2SO4,以此解答该题.
解答 解:KAl(SO4)2溶于水,Al2O3和Fe2O3均不溶于水,混合物A加水溶解后,溶液中是KAl(SO4)2,沉淀是Al2O3和Fe2O3;向沉淀中加NaOH溶液,Fe2O3不反应,Al2O3可与NaOH溶液反应生成NaAlO2,则B为Fe2O3,向NaAlO2溶液中通入CO2可得Al(OH)3沉淀,Al(OH)3受热分解生成Al2O3,则D为Al2O3,反应③为铝热反应,单质C为Al;向溶液中加过量氨水,溶液与过量氨水反应,Al3+被沉淀,得到氢氧化铝沉淀,溶液中剩余的是K2SO4 和(NH4)2SO4,经过蒸发、结晶,得到E中含K2SO4 和(NH4)2SO4,
(1)由以上分析可知固体E中含K2SO4 和(NH4)2SO4,故答案为:K2SO4、(NH4)2SO4;
(2)反应③为铝热反应,方程式为2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3,该反应称为铝热反应,故答案为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3;铝热反应;
(3)反应①为Al2O3和氢氧化钠的反应,离子方程式为Al2O3+2OH-═2AlO2-+H2O,故答案为:Al2O3+2OH-═2AlO2-+H2O;
(4)反应②为Al3+和氨水的反应,反应的离子方程式为Al3++3NH3•H2O═Al(OH)3↓+3NH4+,故答案为:Al3++3NH3•H2O═Al(OH)3↓+3NH4+;
(5)实验室配制氯化亚铁溶液时是把氯化亚铁溶解于煮沸过的蒸馏水中,并加入盐酸和铁粉,盐酸可抑制水解,铁粉可防止亚铁离子被氧化;
氯化亚铁溶液中加入NaOH溶液后,发生反应:FeCl2+2NaOH=Fe(OH)2↓+2NaCl,先生成白色沉淀,白色沉淀迅速经灰绿色并转化为红褐色沉淀,反应的化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:盐酸;铁粉;FeCl2+2NaOH=Fe(OH)2↓+2NaCl;4Fe(OH)2+O2+2H2O=4Fe(OH)3.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、流程中的反应为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的综合应用,题目难度不大.

| A. | 将40gNaOH固体溶解于1L水中 | |
| B. | 将22.4L氯化氢气体溶于水配成1L溶液 | |
| C. | 将1L10mol/L浓盐酸与10L水混合 | |
| D. | 10gNaOH固体溶解在水中配成250mL溶液 |
| A. | N2$→_{放电}^{O_{2}}$NO2$\stackrel{H_{2}O}{→}$HNO3 | |
| B. | MnO2$→_{△}^{浓盐酸}$Cl2$\stackrel{石灰水}{→}$漂白粉 | |
| C. | 黄铁矿$→_{煅烧}^{沸腾炉}$SO2$→_{O_{2}}^{接触室}$SO3$→_{水}^{吸收塔}$稀硫酸 | |
| D. | 铝土矿$→_{过滤}^{NaOH溶液}$NaAlO2溶液$→_{过滤}^{CO_{2}}$Al(OH)3$\stackrel{△}{→}$Al2O3$\stackrel{电解}{→}$Al |
| A. | 乙烯和苯都能使溴水褪色,褪色的原理相同 | |
| B. | 由甲苯硝化制三硝基甲苯(TNT)和由甲苯氧化制苯甲酸属于同一种反应类型 | |
| C. | 煤油可由石油分馏获得,可用作燃料和保存少量金属钠 | |
| D. | 除去C2H2中的杂质H2S,可依次通过盛有酸性KMnO4溶液、浓硫酸的洗气瓶 |
| A. | 原子数 | B. | 分子数 | C. | 密度 | D. | 质子数 |
| A. | 同温同压下,相同体积的物质,它们的物质的量相同 | |
| B. | 常温常压下,等质量的N2与CO所含分子数相同 | |
| C. | 同温同体积下,同质量的H2与O2的压强比约为1:16 | |
| D. | A容器中的H2与B容器中的NH3所含原子总数相等,则两容器的体积比为2:1 |
