题目内容
已知CH4(g)+2O2(g)H2(g)+![]() O2(g)
O2(g)![]() H2O(g) ΔH=-
H2O(g) ΔH=-![]() Q2 kJ·mol-1
Q2 kJ·mol-1
H2(g)+![]() O2(g)
O2(g)![]() H2O(l) ΔH=-
H2O(l) ΔH=-![]() Q3 kJ·mol-1
Q3 kJ·mol-1
常温下取体积比为4∶1的甲烷和氢气的混合气体
C.0.4Q1+0.1Q3 D.0.4Q1+0.2Q2
解析:n(CH4)= =0.4 mol?
=0.4 mol?
n(H2)=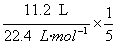 =0.1 mol?
=0.1 mol?
故CH4完全燃烧放出的热量为0.4×Q1。?
H2完全燃烧放出的热量为0.1×![]() Q3=0.05Q3。?
Q3=0.05Q3。?
因而总热量为0.4Q1+0.05Q3。?
答案:A

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:

 CO2(g)+2H2O(l) △H1=a kJ/mol欲计算反应CH4(g)+4NO(g)
CO2(g)+2H2O(l) △H1=a kJ/mol欲计算反应CH4(g)+4NO(g)