题目内容
氧化还原反应综合应用:氧化还原反应滴定
(1)配平氧化还原反应方程式:
C2O42-+ MnO4-+ H+= CO2↑+ Mn2++ H2O
(2)称取6.0 g含H2C2O4·2H2O、KHC2O4和K2SO4的试样,加水溶解,配成250 mL溶液。量取两份此溶液各25 mL,分别置于两个锥形瓶中。
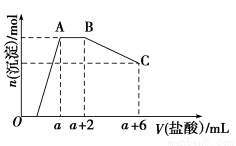
①第一份溶液中加入酚酞试液,滴加0.25 mol·L-1 NaOH溶液至20 mL时,溶液由无色变为浅红色。该溶液被中和的H+的总物质的量为 mol。
②第二份溶液中滴加0.10 mol·L-1的酸性高锰酸钾溶液。
A.KMnO4溶液在滴定过程中作 (填“氧化剂”或“还原剂”),该滴定过程 (填“需要”或“不需要”)另加指示剂。滴至16 mL时反应完全,此时溶液颜色由 变为 。
B.若在接近终点时,用少量蒸馏水将锥形瓶冲洗一下,再继续滴定至终点,则所测结果 (填“偏大”、“偏小”或“无影响”)。
C.若在达到滴定终点时俯视读数,则所得结果 (填“偏大”、“偏小”或“无影响”)。
③原试样中H2C2O4·2H2O的质量分数为 ,KHC2O4的质量分数为 。
(1)5 2 16 10 2 8
(2)①0.005 ②A.氧化剂 不需要 无色 浅紫红色
B.无影响 C.偏小 ③21% 64%
【解析】(1)C:+3―→+4,改变量(4-3)×2=2,Mn:+7―→+2,改变量(7-2)×1=5,根据化合价升降总数相等,所以在C2O42-前配5,MnO4-前配2,根据C和Mn原子守恒,分别在CO2和Mn2+前配10和2,再由电荷守恒在H+前配16,最后根据离子方程式两边的H原子个数相等在水前面配8,经检验离子方程式的氧原子个数相等。
(2)①由H++OH-=H2O知,n(H+)=n(OH-)=0.25 mol·L-1×0.02 L=0.005 mol。②原溶液无色,而KMnO4为紫红色,所以当溶液中的H2C2O4和KHC2O4反应完全时,溶液呈浅紫红色。由得失电子守恒得,n(还)×2=0.10 mol·L-1×0.016 L×5,n(还)=0.004 mol。③设6.0 g试样中H2C2O4·2H2O、KHC2O4的物质的量分别为n(H2C2O4·2H2O)、n(KHC2O4),由①得:2n(H2C2O4·2H2O)+n(KHC2O4)=0.05 mol,由②得:n(H2C2O4·2H2O)+n(KHC2O4)=0.04 mol,解上述两个方程式得:n(H2C2O4·2H2O)=0.01 mol,n(KHC2O4)=0.03 mol,H2C2O4·2H2O的质量分数为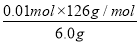 ×100%=21%,KHC2O4的质量分数为
×100%=21%,KHC2O4的质量分数为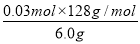 ×100%=64%。
×100%=64%。

铁在冷的浓硫酸中能发生钝化。某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体。实验室现有下列试剂:0.01 mol/L酸性KMnO4溶液、0.1 mol/L KI溶液、3%H2O2溶液、淀粉溶液、蒸馏水。请你协助他们探究所得溶液和气体的成分。
【提出猜想】
Ⅰ.所得溶液中的金属离子可能含有Fe2+和Fe3+中的一种或两种;
Ⅱ.所得气体中可能含有________中的一种或两种。
| 实验操作 | 预期现象 | 结论 |
验证猜想Ⅰ | 步骤①:取少量0.01 mol/L酸性KMnO4溶液,滴入所得溶液 |
|
|
步骤②:________ |
| 含有Fe3 | |
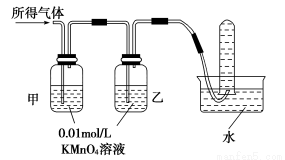
验证猜想Ⅱ | 将所得气体通入如下装置 |
| 含有两种气体 |
【实验探究】
【问题讨论】
有同学提出,若另外选用KSCN溶液,则仅利用KSCN和H2O2两种溶液即可完成猜想Ⅰ的所有探究,判断该方法是否正确并进行评价:_____________________________