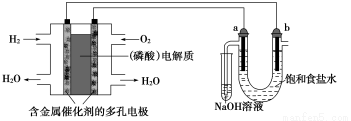
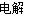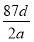ΧβΡΩΡΎ»ί
ΫϋΡξά¥ΒΊ÷ ΓΔΜΖΨ≥‘÷Ρ―ΤΒΤΒΖΔ…ζΘ§ΈΣΖά÷Ι‘Ύ¥σ‘÷÷°Κσ“Ώ≤ΓΝς––Θ§‘÷«χ–η“Σ¥σΝΩΒΡΗς÷÷œϊΕΨΦΝΓΔΤ·ΑΉΦΝΒ»ΓΘ
(1)Εΰ―θΜ·¬» «ΡΩ«ΑΙζΦ …œΙΪ»œΒΡΒΎΥΡ¥ζΗΏ–ßΓΔΈόΕΨΒΡΙψΤΉœϊΕΨΦΝΘ§ΥϋΩ…”…KClO3”κSO2‘ΎH2SO4Ής”Οœ¬Ζ¥”Π÷ΤΒΟΓΘ«κ–¥≥ωΖ¥”ΠΒΡάκΉ”ΖΫ≥Χ ΫΘΚ ΓΘ
(2)ΙΐΧΦΥαΡΤ «“Μ÷÷–¬–ΆΙΧΧ§Τ·ΑΉΦΝΘ§Μ·―ß ΫΩ…±μ ΨΈΣNa2CO3ΓΛ3H2O2Θ§ΥϋΨΏ”–Na2CO3ΚΆH2O2ΒΡΥΪ÷Ί–‘÷ ΓΘΙΐΧΦΥαΡΤ”κœ¬Ν–Έο÷ ΨυΜαΖΔ…ζΜ·―ßΖ¥”ΠΕχ ß–ßΘ§Τδ÷–ΙΐΧΦΥαΡΤ÷ΜΖΔ…ζΝΥ―θΜ·Ζ¥”ΠΒΡ « ΓΘ
AΘ°MnO2 BΘ°KMnO4»ή“Κ CΘ°œΓ―ΈΥα DΘ°Na2SO3»ή“Κ
(3)Τ·ΑΉΦΝ―«¬»ΥαΡΤ(NaClO2)‘Ύ≥ΘΈ¬œ¬ΚΎΑΒ¥ΠΩ…±Θ¥φ“ΜΡξΘ§HClO2≤ΜΈ»Ε®Ω…Ζ÷ΫβΘ§Ζ¥”ΠΒΡάκΉ”ΖΫ≥Χ ΫΈΣHClO2®DΓζClO2ΓϋΘΪHΘΪΘΪClΘ≠ΘΪH2O(Έ¥≈δΤΫ)ΓΘΒ±1 mol HClO2Ζ÷Ϋβ ±Θ§ΉΣ“ΤΒΡΒγΉ” ΐ « ΓΘ
(1)2ClO3Θ≠ΘΪSO2=2ClO2ΘΪSO42Θ≠ΓΓ(2)BΓΓ(3)0.8ΓΝ6.02ΓΝ1023(Μρ4.816ΓΝ1023)
ΓΨΫβΈωΓΩ(1)ClO3Θ≠±ΜSO2ΜΙ‘≠ΈΣClO2Θ§SO2±ΜClO3Θ≠―θΜ·ΈΣSO42Θ≠Θ§ΤδάκΉ”Ζ¥”ΠΖΫ≥Χ ΫΈΣΘΚ2ClO3Θ≠ΘΪSO2=2ClO2ΘΪSO42Θ≠ΓΘ(2)Na2CO3ΓΛ3H2O2Ζ¥”Π ±Θ§”κ―θΜ·ΜΙ‘≠Ζ¥”ΠœύΙΊΒΡ «H2O2Θ§H2O2±ΜMnO2¥ΏΜ·Ζ÷Ϋβ…ζ≥…H2OΓΔO2Θ§ΙΐΧΦΥαΡΤΦ»ΖΔ…ζ―θΜ·Ζ¥”Π“≤ΖΔ…ζΜΙ‘≠Ζ¥”ΠΘΜKMnO4»ή“ΚΨΏ”–«Ω―θΜ·–‘Θ§ΡήΫΪH2O2―θΜ·…ζ≥…O2Θ§ΙΐΧΦΥαΡΤ÷–H2O2÷ΜΖΔ…ζ―θΜ·Ζ¥”ΠΘΜNa2SO3±ΜH2O2―θΜ·Θ§ΙΐΧΦΥαΡΤ÷–H2O2ΖΔ…ζΜΙ‘≠Ζ¥”ΠΘΜΙΐΧΦΥαΡΤ”κœΓ―ΈΥα≤ΜΖΔ…ζ―θΜ·ΜΙ‘≠Ζ¥”ΠΓΘ
(3)≈δΤΫΖ¥”ΠΘΚ5HClO2=4ClO2ΓϋΘΪHΘΪΘΪClΘ≠ΘΪ2H2OΘ§5 mol HClO2Ζ÷ΫβΉΣ“Τ4 molΒγΉ”Θ§Ι 1 mol HClO2ΖΔ…ζΖ÷ΫβΖ¥”ΠΘ§ΉΣ“Τ0.8 molΒγΉ”Θ§Φ¥ ΐΡΩΈΣ0.8ΓΝ6.02ΓΝ1023ΓΘ

 » Α°”Δ”οΆ§≤ΫΝΖœΑ≤αœΒΝ–¥πΑΗ
» Α°”Δ”οΆ§≤ΫΝΖœΑ≤αœΒΝ–¥πΑΗ ―ßœΑ ΒΦυ‘ΑΒΊœΒΝ–¥πΑΗ
―ßœΑ ΒΦυ‘ΑΒΊœΒΝ–¥πΑΗΗυΨί“‘œ¬–π ω÷Τ±Η¬»Μ·Ά≠ΘΚœ»ΫΪ≈®―ΈΥα”Ο’τΤϊΦ”»»÷Ν80 ΓφΉσ”“Θ§¬ΐ¬ΐΦ”»κΚ§”–FeO‘”÷ ΒΡCuOΖέΘ§≥δΖ÷Ζ¥”ΠΘ§ ΙΤδ»ήΫβΓΘ“―÷ΣΘΚFeS≤Μ»ή”ΎΥ°Θ§ΒΪ»ή”ΎΥαΓΘ
»ή“Κ÷–±Μ≥ΝΒμάκΉ” | Fe3ΘΪ | Fe2ΘΪ | Cu2ΘΪ |
Άξ»Ϊ…ζ≥…«β―θΜ·Έο≥ΝΒμ ±Θ§»ή“ΚΒΡpH | Γί3.7 | Γί9.6 | Γί6.4 |
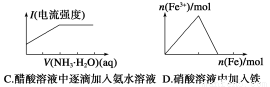
‘Ύ≥ΐ»Ξ»ή“Κ÷–ΒΡFe2ΘΪ ±Θ§Ω…≤…”ΟΒΡΖΫΖ® «(ΓΓΓΓ)
AΘ°Ω…÷±Ϋ”Φ”ΦνΘ§Βς’ϊ»ή“ΚΒΡpHΓί9.6
BΘ°Φ”»κ¥ΩΆ≠ΖέΘ§ΫΪFe2ΘΪΜΙ‘≠ΈΣFe
CΘ°œ»ΫΪFe2ΘΪ―θΜ·≥…Fe3ΘΪΘ§‘ΌΒς’ϊ»ή“ΚpH÷Ν3ΓΪ4
DΘ°Ά®»κH2S ΙFe2ΘΪ÷±Ϋ”≥ΝΒμ