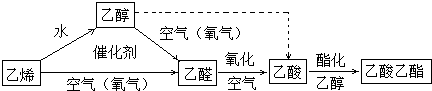
题目内容
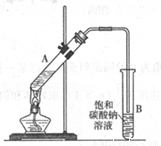
乙酸乙酯是重要的化工原料。实验室合成乙酸乙酯的装置如下图所示。
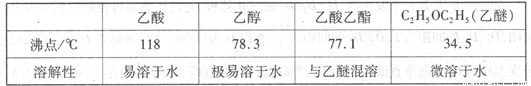
有关数据及副反应:
副反应:
C2H5OH+C2H5OH C2H5OC2H5+H2O
C2H5OC2H5+H2O
请回答下列问题:
(1)在大试管A中添加的试剂有6 mL乙醇、4 mL乙酸和4 mL浓硫酸,这三种试剂的添加顺序依次为 _______、_______ 、_______
(2)试管B中导管接近液面未伸入液面下的理由是 _______
(3)现对试管B中乙酸乙酯粗产品进行提纯,步骤如下:
①将试管B中混合液体充分振荡后,转入 _______(填仪器名称)进行分离;
②向分离出的上层液体中加入无水硫酸钠,充分振荡。加入无水硫酸钠的目的是:
③将经过上述处理的液体放入干燥的蒸馏烧瓶中,对其进行蒸馏,收集_______0C左右的液体即得纯净的乙酸乙酯。
(4)从绿色化学的角度分析,使用浓硫酸制乙酸乙酯不足之处主要有____________________
(5)炒菜时,加一点白酒和醋能使菜肴昧香可口,试用符合实际情况的化学方程式解释: ___ _______________
(15分)
(1)乙醇、浓硫酸、乙酸(3分)
(2)防止产生倒吸(2分)
(3)①分液漏斗(2分) ②除去粗产品中的水(2分) ③77(或77.1)(2分)
(4)产生大量的酸性废液污染环境(1分),有副反应发生(1分)
(5)CH3COOH+HOCH2CH3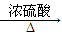 CH3COOCH2CH3+H2O
(2分)
CH3COOCH2CH3+H2O
(2分)
【解析】
试题分析:(1)浓硫酸密度大,应将浓硫酸加入到乙醇中,以防酸液飞溅,乙酸易挥发,冷却后再加入乙酸;添加顺序依次乙醇、浓硫酸、乙酸(2)试管受热不均,试管乙中的导管伸入液面下可能发生倒吸;从反应装置出来的为蒸气,导管具有冷凝作用;(3) ①乙酰乙酸乙酯难溶于水,可使生成的有机物分层,可用分液漏斗分离;②无水硫酸钠固体具有吸水的作用,故答案为:干燥水分;③由乙酸乙酯的沸点可知要搜集77.10C的液体。(4)消耗大量的浓硫酸,反应后得到的是含有稀硫酸的废液,污染环境。温度控制不好会有副反应发生。(5)乙酸乙酯反应的化学方程式CH3COOH+HOCH2CH3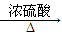 CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
考点:乙酸乙酯的制取; 物质的分离、提纯的基本方法选择与应用。

 名校课堂系列答案
名校课堂系列答案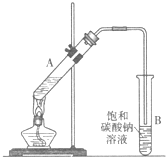 乙酸乙酯是重要的化工原料.实验室合成乙酸乙酯的装置如图所示.
乙酸乙酯是重要的化工原料.实验室合成乙酸乙酯的装置如图所示.有关数据及副反应:
| 乙酸 | 乙醇 | 乙酸乙酯 | 乙醚 | |
| 沸点/℃ | 118 | 78.3 | 77.1 | 34.5 |
| 溶解性 | 易溶于水 | 极易溶于水 | 与乙醚混溶 | 微溶于水 |
| 浓硫酸 |
| ℃140 |
请回答下列问题:
(1)在大试管A中添加的试剂有6mL乙醇、4mL乙酸和4mL浓硫酸,这三种试剂的添加顺序依次为
(2)试管B中导管接近液面未伸入液面下的理由是
(3)现对试管B中乙酸乙酯粗产品进行提纯,步骤如下:
①将试管B中混合液体充分振荡后,转入
②向分离出的上层液体中加入无水硫酸钠,充分振荡.加入无水硫酸钠的目的是:
③将经过上述处理的液体放入干燥的蒸馏烧瓶中,对其进行蒸馏,收集
(4)从绿色化学的角度分析,使用浓硫酸制乙酸乙酯不足之处主要有
(5)炒菜时,加一点白酒和醋能使菜肴昧香可口,试用符合实际情况的化学方程式解释:
实验步骤:
向试管中加入8mLNaOH溶液,再加入2mL乙酸乙酯,用直尺量出乙酸乙酯的高度.再把试管放入70℃的水浴中,每隔1min将其取出,振荡,静置,立即测量并记录剩余酯层的高度.再迅速放回水浴中继续加热,如此反复进行.改变NaOH溶液浓度,重复实验.数据记录:
乙酸乙酯水解后剩余的高度/min
| 组别 | c(NaOH)/mol?L-1 | 时间/min | |||||||
| 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | ||
| 1 | 0.5 | 10.0 | 9.0 | 8.0 | 7.5 | 7.0 | 6.5 | 6.5 | 6.5 |
| 2 | 1.0 | 10.0 | 8.5 | 7.0 | 6.0 | 5.0 | 4.5 | 4.5 | 4.5 |
| 3 | 2.0 | 10.0 | 8.0 | 6.0 | 4.5 | 3.0 | 2.0 | 1.5 | 1.5 |
(1)完成上述对比实验时,每组实验都必须控制不变的因素有
(2)分析上述数据,得到乙酸乙酯水解速率的结论是:
①
②乙酸乙酯水解速率先快后慢,一段时间后达到平衡状态.
(3)结论②的理论解释是
(4)欲使乙酸乙酯完全水解,可采取的措施是
(5)有同学认为有必要用蒸馏水代替NaOH溶液重复试验,对数据进行修正,主要原因是