题目内容
19.下列叙述中正确的是( )| A. | H2SO4的摩尔质量是98 | |
| B. | 2mol NO中含2mol氮和2mol O | |
| C. | 等质量的O2和O3中所含氧原子个数相同 | |
| D. | 1mol O22-的质量为34g |
分析 A.H2SO4的摩尔质量是98g/mol;
B.使用物质的量应指明具体的物质或微粒,选项中“2mol氮”指代不明确;
C.O2和O3均匀氧原子构成,二者质量相等,则含有氧原子个数相同;
D.O22-的摩尔质量为32g/mol.
解答 解:A.H2SO4的相对分子质量为98,摩尔质量是98g/mol,故A错误;
B.使用物质的量应指明具体的物质或微粒,2mol NO中含2molN原子和2mol O原子,故B错误;
C.O2和O3均匀氧原子构成,二者质量相等,则含有氧原子个数相同,故C正确;
D.O22-的摩尔质量为32g/mol,1mol O22-的质量为32g,故D错误,
故选:C.
点评 本题考查物质的量及有关计算、摩尔质量等,比较基础,注意使用物质的量应指明具体的物质或微粒.

练习册系列答案
相关题目
9.下列物质一定属于同系物的是( )
① ②
② ③
③ ④C2H4⑤CH2═CH-CH═CH2⑥C3H6
④C2H4⑤CH2═CH-CH═CH2⑥C3H6
⑦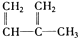 ⑧
⑧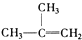
①
 ②
② ③
③ ④C2H4⑤CH2═CH-CH═CH2⑥C3H6
④C2H4⑤CH2═CH-CH═CH2⑥C3H6⑦
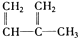 ⑧
⑧
| A. | ④和⑧ | B. | ①、②和③ | C. | ⑤和⑦ | D. | ④、⑥和⑧ |
10.下列溶液中的c(Cl-)与50mL 1mol/L氯化铝溶液中的c(Cl-)相等的是( )
| A. | 150mL 1mol/L氯化钠溶液 | B. | 75mL 2mol/L氯化镁溶液 | ||
| C. | 150mL 1.5mol/L氯化钾溶液 | D. | 75mL 1mol/L氯化铁溶液 |
7.已知反应:
①101kPa时,2C(s)+O2(g)═2CO(g)△H=-221kJ•mol-1
②稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1
下列结论正确的是( )
①101kPa时,2C(s)+O2(g)═2CO(g)△H=-221kJ•mol-1
②稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1
下列结论正确的是( )
| A. | 碳的燃烧热大于110.5 kJ•mol-1 | |
| B. | 2C(g)+O2(g)═2CO(g)△H>-221 kJ•mol-1 | |
| C. | 98%的浓硫酸与稀氢氧化钠溶液反应生成1mol水的中和热为-57.3kJ•mol-1 | |
| D. | 稀醋酸与稀氢氧化钠溶液反应生成1mol水时放出57.3kJ的热量 |
14.鉴别甲苯、己烯、苯酚溶液、丙烯酸溶液、乙醇,可选用的试剂是( )
| A. | KMnO4溶液、FeCl3溶液 | B. | 溴水、KMnO4溶液 | ||
| C. | NaOH溶液、FeCl3溶液 | D. | 溴水、Na2CO3溶液 |
4.通过量CO2于下列溶液中,出现浑浊的是( )
| A. | Ba(NO3)2溶液 | B. | 饱和澄清石灰水 | C. | Na2SO4溶液 | D. | 饱和Na2CO3溶液 |
17.在恒温条件下,向盛有食盐的2L恒容密闭容器中加入0.2molNO2,0.2molNO和0.1molCl2,发生如下两个反应:
①2NO2(g)+NaCl(s)═NaNO3(s)+ClNO(g)△H1<0 平衡常数K1
②2NO(g)+Cl2(g)═2ClNO(g)△H2<0 平衡常数K2
10min时反应达到平衡,测得容器内体系的压强减少20%,10min内用ClNO(g)表示的平均反应速率v(ClNO)═7.0×10-3mol•L•min-1.
下列说法正确的是( )
①2NO2(g)+NaCl(s)═NaNO3(s)+ClNO(g)△H1<0 平衡常数K1
②2NO(g)+Cl2(g)═2ClNO(g)△H2<0 平衡常数K2
10min时反应达到平衡,测得容器内体系的压强减少20%,10min内用ClNO(g)表示的平均反应速率v(ClNO)═7.0×10-3mol•L•min-1.
下列说法正确的是( )
| A. | 反应4NO2(g)+2NaCl(s)═2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数$\frac{{{k}_{1}}^{2}}{{k}_{2}}$ | |
| B. | 平衡后c(Cl2)=2.5×10-2mol•L-1 | |
| C. | 其他条件保持不变,反应在恒压条件下进行,则平衡常数K2增大 | |
| D. | 平衡时NO2的转化率为50% |
18.同温同压下,相同体积的H2和He具有相同的( )
| A. | 质量 | B. | 原子数 | C. | 分子数 | D. | 摩尔质量 |
