题目内容
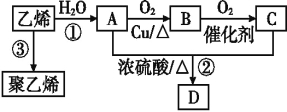
【题目】海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如下图:

(1)指出提取碘的过程中有关的实验操作名称:
①____________;写出过程②中有关反应的离子方程式: _________
(2)灼烧海带用到的仪器有_____________
(3)提取碘的过程中,可供选择的有机试剂是(____)
A .酒精 B .四氯化碳
C .甘油 D .醋酸
【答案】过滤; 2I-+Cl2=I2+2Cl-; 坩埚、酒精灯、泥三角、三脚架; B
【解析】
(1)分离固体和液体用过滤,利用溶解性的差异来分析。②中Cl2将I-氧化成I2;
(2)灼烧固体用到坩埚、酒精灯、泥三角、三脚架;
(3)萃取的基本原则两种溶剂互不相溶,且溶质在一种溶剂中的溶解度比在另一种大的多。
(1)过滤适用于不溶于水的固体和液体,根据流程可知,分离固体海带灰和液体碘离子的溶液用过滤。②中的反应是Cl2将I-氧化成I2的反应,过程②中有关反应的离子方程式为2I-+Cl2=I2+2Cl-;
(1)灼烧海带的仪器是坩埚、用于加热的仪器是酒精灯、放置坩埚的仪器是泥三角、三脚架;
(3)萃取的基本原则两种溶剂互不相溶,且溶质在一种溶剂中的溶解度比在另一种大的多,故可用四氯化碳或苯等,酒精、醋酸、甘油等和水是互溶的,不能选择。答案选B。

【题目】利用如图所示装置进行下列实验,能得出相应实验结论的是( )

选项 | ① | ② | ③ | 实验结论 |
A | 稀盐酸 | CaCO3 | Na2SiO3溶液 | 非金属性:Cl>C>Si |
B | 浓硫酸 | 蔗糖 | Ba(NO3)2溶液 | 验证SO2与可溶性钡盐可生成白色沉淀 |
C | 浓氨水 | 生石灰 | 酚酞溶液 | 氨气的水溶液呈碱性 |
D | 浓硝酸 | Fe | NaOH溶液 | 铁和浓硝酸反应可生成NO2 |
A. A B. B C. C D. D
【题目】十九大报告提出要“打赢蓝天保卫战”,意味对环境污染防治比过去要求更高。
(1)烟气中的氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) H < 0 平衡常数K1
NaNO3(s)+ClNO(g) H < 0 平衡常数K1
2NO(g)+Cl2(g)![]() 2ClNO(g) H < 0 平衡常数K2
2ClNO(g) H < 0 平衡常数K2
4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=__________(用K1、K2表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=__________(用K1、K2表示)。
(2)利用CO可将NO转化为无害的N2,其反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)。
N2(g)+2CO2(g)。
在容积均为1 L的甲、乙、丙三个恒温(反应温度分别为300℃、T℃、300℃)容器中分别加入物质的量之比为1:1的NO和CO,测得各容器中n(CO)随反应时间t的变化情况如下表所示:
t/min n(CO) /mol | 0 | 40 | 80 | 120 | 160 |
甲 | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
乙 | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
丙 | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
① 甲容器中,0~40min内用NO的浓度变化表示的平均反应速率v(NO)=_______。
② T ___ 300℃,该反应的△H______0(填“>”或“<”)。
③ 甲容器达平衡时α(NO)=_______。
丙容器达平衡时c(NO)可能为________0.4mol/L(填“>”、“=”或“<”)。
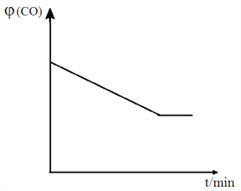
④ 已知甲容器CO的体积分数![]() (CO)随时间t的变化如图,画出其他条件不变,绝热条件下,
(CO)随时间t的变化如图,画出其他条件不变,绝热条件下, ![]() (CO)随时间t的变化示意图。_____________________
(CO)随时间t的变化示意图。_____________________
(3)处理含镉废水常用化学沉淀法。以下是几种镉的难溶化合物25℃时的溶度积常数: Ksp(CdCO3)=5.2×10-12 Ksp(CdS)=3.6×10-29 Ksp(Cd(OH)2)=2.0×10-16,
回答下列问题:
若采用生石灰处理含镉废水最佳pH为11,此时溶液中c(Cd2+)=_________。沉淀Cd2+效果最佳的试剂是____________
a.Na2CO3 b.Na2S c.CaO