题目内容
【题目】100℃时,向容积为2L的密闭容器中充入一定量的X气体和Y气体,发生如下反应:X(g)+2Y(g) ![]() Z(g)反应过程中测定的部分数据见下表:
Z(g)反应过程中测定的部分数据见下表:
反应时间/min | n(X)/mol | n(Y)/ mol |
0 | 2.00 | 2.40 |
10 | 1.00 | |
30 | 0.40 |
下列说法正确的是
A. 前10 min内反应的平均速率为v(Z)=0.10 mol·L-1·min-1
B. 温度为200℃时,上述反应平衡常数为20,则正反应为吸热反应
C. 若密闭容器体积可变,其他条件不变,在达到平衡后缩小容器体积为原来一半,则c(X)<1mol/L
D. 保持其他条件不变,向容器中再充入1.00 mol X气体和1.20 mol Y气体,到达平衡后,X转化率增大
【答案】CD
【解析】A.根据v=![]() 计算X的速率为
计算X的速率为 molL-1min-1=0.05molL-1min-1,由于X和Z的计量数之比为1︰1,所以Z的速率为0.05molL-1min-1,故A错误;C.100℃时,根据表中的数据结合方程式可知,在10min和30min时物质浓度相同,即反应在10min时就处于平衡状态,此时X为1.00mol,Y为0.4mol,Z为1.00mol,所以此时平衡常数K=
molL-1min-1=0.05molL-1min-1,由于X和Z的计量数之比为1︰1,所以Z的速率为0.05molL-1min-1,故A错误;C.100℃时,根据表中的数据结合方程式可知,在10min和30min时物质浓度相同,即反应在10min时就处于平衡状态,此时X为1.00mol,Y为0.4mol,Z为1.00mol,所以此时平衡常数K=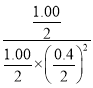 =25,而200℃时平衡常数为20,所以升高温度,平衡逆向移动,所以该反应的正反应为放热反应,故B错误;C.100℃平衡时c(X)=0.5mol/L,其他条件不变,在达到平衡后缩小容器体积为原来一半,c(X)瞬间变为1.0mol/L,此时平衡正向移动,重新平衡后c(X)<1mol/L,故C正确;D.保持其他条件不变,向容器中再充入1.00 mol X气体和1.20 mol Y气体,此时Qc=
=25,而200℃时平衡常数为20,所以升高温度,平衡逆向移动,所以该反应的正反应为放热反应,故B错误;C.100℃平衡时c(X)=0.5mol/L,其他条件不变,在达到平衡后缩小容器体积为原来一半,c(X)瞬间变为1.0mol/L,此时平衡正向移动,重新平衡后c(X)<1mol/L,故C正确;D.保持其他条件不变,向容器中再充入1.00 mol X气体和1.20 mol Y气体,此时Qc= =0.78<25,此时反应正向进行,到达平衡后,X转化率增大,故D正确;故选CD。
=0.78<25,此时反应正向进行,到达平衡后,X转化率增大,故D正确;故选CD。

【题目】A、B、C、X、Y、Z是元素周期表中的前20号元素,且原子序数依次增大。已知它们的部分化合物的性质如下:
A的 氢化物 | B的 氢化物 | C的 氢化物 | X的 氧化物 | Y的氢化物 分子构型 | Z原子 |
含氢量最高 的有机物 | 水溶液 呈碱性 | 水溶液 呈酸性 | 两性 氧化物 | 正四面体 | 价电子排布为4s2 |
回答下列问题:
(1)写出对应元素的名称:A__________、B__________、C__________、X__________、Y__________、Z__________
(2)X、Y、Z三种元素原子半径由大到小的顺序是(用元素符号和“>”表示):__________
(3)写出B的氢化物与C的氢化物反应后生成物的电子式:__________。
(4)已知C的单质能在水中产生一种常见的氧化性单质,试写出该反应的化学方程式:
__________。
(5)试比较A和Y的最高价氧化物熔点的高低(用具体物质化学式和">"、"<"或"="表示:)__________并说明理由__________。
【题目】下列实验操作和现象与所得结论一定正确的是
选项 | 操作 | 现象 | 结论或解释 |
A | 向黄色的Fe(NO)3溶液中滴加氢碘酸,再加入一定量CCl4振荡并静置 | 下层溶液变为紫红色 | 氧化性:Fe3+>I2 |
B | 向某无色溶液中滴加稀盐酸,将产生的无色气体通入品红溶液 | 品红溶液褪色 | 原溶液中一定大量存在SO32- |
C | 向Mg2+和Cu2+共存的溶液中滴加适量 NaOH溶液,过滤、洗涤 | 得到白色沉淀 | 相同温度下,溶度积常数: Ksp[Mg(OH)2]< Ksp [Cu(OH)2] |
D | 一定温度下,向K2Cr2O7溶液中加入少量KOH溶液 | 溶液橙色变浅 | 减小H+浓度, Cr2O72-+H2O |
A. A B. B C. C D. D



