题目内容
(6分)已知下列两个热化学方程式:
2H2(g)+O2(g)=2H2O(l); ΔH=-571.6kJ/mol
C3H8(g)+5O2(g)=3CO2(g)+4H2O(l); ΔH=-2220kJ/mol
实验测得氢气和丙烷的混合气体共5mol,完全燃烧时放出热量3847kJ,则混合气体中氢气和丙烷的体积比为多少?
2H2(g)+O2(g)=2H2O(l); ΔH=-571.6kJ/mol
C3H8(g)+5O2(g)=3CO2(g)+4H2O(l); ΔH=-2220kJ/mol
实验测得氢气和丙烷的混合气体共5mol,完全燃烧时放出热量3847kJ,则混合气体中氢气和丙烷的体积比为多少?
3 :1
试题分析:混合气体的物质的量为5 mol。设混合气体中氢气的物质的量为x ,丙烷的物质的量为y。
285.8 x + 2220 y = 3847
x + y = 5
解出x = 3.75 y = 1.25
x:y = 3 :1
点评:此题不难,考查混合物的计算,利用氢气和丙烷的燃烧热可计算出。

练习册系列答案
相关题目
 O2(g)===CO(g) △H2
O2(g)===CO(g) △H2 2NH3(g) △H=-93 kJ·mol-1。试根据表中所列键能数据,计算a 的数值为_______kJ/mol。
2NH3(g) △H=-93 kJ·mol-1。试根据表中所列键能数据,计算a 的数值为_______kJ/mol。
 CO+3H2的焓变△H=_______。
CO+3H2的焓变△H=_______。
 SO3(g) △H = ―98.32kJ/mol,在容器中充入2molSO2 和1molO2充分反应,最终放出的热量为
SO3(g) △H = ―98.32kJ/mol,在容器中充入2molSO2 和1molO2充分反应,最终放出的热量为 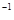 可知,金刚石比石墨稳定
可知,金刚石比石墨稳定 (aq))+OH
(aq))+OH (aq))=H
(aq))=H O(l)△H=-57.3 kJ·mol
O(l)△H=-57.3 kJ·mol 的浓硫酸与含1 mol NaOH的溶液混合,放出的热大于57.3 kJ
的浓硫酸与含1 mol NaOH的溶液混合,放出的热大于57.3 kJ
 =
=


 ;
;
 燃烧热的化学方程式为:
燃烧热的化学方程式为:



