题目内容
(09江苏高考化学)(10分)联氨(N2H4)及其衍生物是一类重要的火箭燃料,N2H4与N2O4能放出大量的热。
(1)已知:2NO2(g)=N2O4(g) △H=-57.20kJ·mol-1。一定温度下,在密闭容器中反应2NO2(g)=N2O4(g) 达到平衡。其它条件不变时,下列措施能提高NO2转化率的是 (填字母)。
A.减小NO2的浓度 B.降低温度C.增加NO2的浓度 D.升高温度
(2)25℃时,1.00gN2H4(l)与足量N2O4(l)完全反应生成N2(g)和H2O (l) ,放出19.14kJ
的热量。则反应2N2H4(l)+N2O4(l)=3N2(g)+4H2O (l)的△H= kJ·mol-1
(3)17℃、1.01×105Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.0300mol·L-1、c(N2O4)=0.0120mol·L-1。计算反应2 NO2(g)![]() N2O4(g)的平衡常数K。
N2O4(g)的平衡常数K。
(4)现用一定量的Cu 与足量的浓HNO3 反应,制得1.00L已达平衡的N2O4和NO2 混合气体(17℃、1.01×105Pa),理论上至少需消耗Cu 多少克?
(1)BC (2)-1224.96
(3)根据题意知平衡时: c(N2O4 )=0.0120mol·L-1 ,c(NO2)=0.0300mol·L-1
K= c(N2O4 )/c2(NO2) =0.0120/0.0300×0.0300 =13.3 答:平衡常数为13.3。
(4)由(3)可知,在17℃、1.01×105Pa达到平衡时,1.00L混合气体中: n(N2O4 )=c(N2O4)×V=0.0120mol·L-1×1.00L=0.0120mol , n(NO2 )=c(NO2)×V=0.0300mol·L-1×1.00L=0.0300mol ,则n总(NO2 )=n(NO2 )+2×n(N2O4 )=0.0540mol 由Cu+4HNO3=Cu(NO3)2+2NO2↑+2H2O可得:m(Cu)= 64g·mol-1×0.0540mol /2 =1.73g 答:理论上至少需消耗Cu 1.73g。
解析:
(1)由于该反应为气体体积减小的放热反应,要提高NO2转化率,则应该采取:①降低温度,②增加NO2的浓度③增大压强等措施,所以B、C符合要求;(2)由1.00gN2H4(l)放出19.14kJ,则2mol(即64g)N2H4(l)放热为1224.96kJ, 所以 △H=1224.96kJ·mol-1(3)、(4)见答案。

(09江苏高考化学)医用氯化钙可用于生产补钙、抗过敏和消炎等药物。以工业碳酸钙(含有少量Na+、Al3+、Fe3+等杂质)生产医药级二水合氯化钙(CaCl2·2H2O的质量分数为97.0%~103.0%)的主要流程如下:
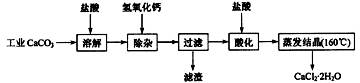 |
(1)除杂操作是加入氢氧化钙,调节溶液的pH为8.0~8.5,以除去溶液中的少量 Al3+、Fe3+。检验Fe(OH)3是否沉淀完全的实验操作是 。
(2)酸化操作是加入盐酸,调节溶液的pH为4.0,其目的有:①将溶液中的少量 Ca(OH)2 转化为CaCl2;②防止Ca2+在蒸发时水解;③ 。
(3)测定样品中Cl-含量的方法是:a.称取0.7500g样品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测液于锥形瓶中;c.用0.05000mol·L-1 AgNO3 溶液滴定至终点,消耗AgNO3 溶液体积的平均值为20.39mL。①上述测定过程中需用溶液润洗的仪器有: 。②计算上述样品中CaCl2·2H2O的质量分数为: 。③若用上述方法测定的样品中CaCl2·2H2O的质量分数偏高(测定过程中产生的误差可忽略),其可能原因有: ; 。