题目内容
(09江苏高考化学)下列离子方程式与所述事实相符且正确的是:
A.漂白粉溶液在空气中失效:CIO-+CO2+H2O=HClO+HCO3-
B.用浓盐酸与MnO2 反应制取少量氯气:MnO2+2H++2Cl-![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
C.向NaAlO2 溶液中通入过量的CO2 制取Al(OH)3:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
D.在强碱溶液中,次氯酸钠与Fe(OH)3反应生成Na2FeO4:
3ClO-+2Fe(OH)3=2FeO42-+3Cl-+H2O+4H+
C
解析:
漂白粉若失效,则不可能存在HClO,所以与事实不符,A错误;
虽然与事实相符,但B的方程式中氢原子没有配平,是错误的;
强碱溶液中不可能生成H+,所以与事实不符,D是错误的;

(09江苏高考化学)医用氯化钙可用于生产补钙、抗过敏和消炎等药物。以工业碳酸钙(含有少量Na+、Al3+、Fe3+等杂质)生产医药级二水合氯化钙(CaCl2·2H2O的质量分数为97.0%~103.0%)的主要流程如下:
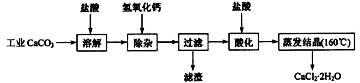 |
(1)除杂操作是加入氢氧化钙,调节溶液的pH为8.0~8.5,以除去溶液中的少量 Al3+、Fe3+。检验Fe(OH)3是否沉淀完全的实验操作是 。
(2)酸化操作是加入盐酸,调节溶液的pH为4.0,其目的有:①将溶液中的少量 Ca(OH)2 转化为CaCl2;②防止Ca2+在蒸发时水解;③ 。
(3)测定样品中Cl-含量的方法是:a.称取0.7500g样品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测液于锥形瓶中;c.用0.05000mol·L-1 AgNO3 溶液滴定至终点,消耗AgNO3 溶液体积的平均值为20.39mL。①上述测定过程中需用溶液润洗的仪器有: 。②计算上述样品中CaCl2·2H2O的质量分数为: 。③若用上述方法测定的样品中CaCl2·2H2O的质量分数偏高(测定过程中产生的误差可忽略),其可能原因有: ; 。