题目内容
【题目】在不同温度下按照相同物质的量投料发生反应:CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g) ![]() H<0,测得CO的平衡转化率与压强的关系如图所示,有关说法正确的是 ( )
H<0,测得CO的平衡转化率与压强的关系如图所示,有关说法正确的是 ( )
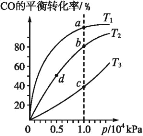
A.反应温度:T1>T2>T3
B.正反应速率:v 正(d)=v 正(b)
C.混合气体密度:ρ(a)>ρ(b)
D.混合气体平均摩尔质量:M(b)<M(c)
【答案】C
【解析】
A.该反应为放热反应,温度越高,转化率越低,则温度:T3>T2>T1,故A错误;
B.b、d温度相同,压强不同,压强越大,反应速率越快,则正反应速率:ν(b)>ν(d),故B错误;
C. 反应前后均为气体,混合气体总质量不变,相同压强下,温度越高,体积越大,密度越小:ρ(a)>ρ(b),故C正确;
D.质量不变,CO的转化率越大,平衡后气体的物质的量越小,则M越大,则平均摩尔质量:M(b)>M(c),故D错误;
故选C。

【题目】下列实验操作、现象与结论对应关系正确的是![]()
选项 | 实验操作 | 实验现象 | 结论 |
A | 常温下铜片插入浓硫酸中 | 无明显现象 | 常温下铜被浓硫酸钝化 |
B | 将 | 溶液红色褪去 |
|
C | 等体积 | HX放出的氢气多且反应速率快 | HX酸性比HY弱 |
D | 先向 | 开始有白色沉淀生成;后又有黑色沉淀生成 |
|
A.AB.BC.CD.D
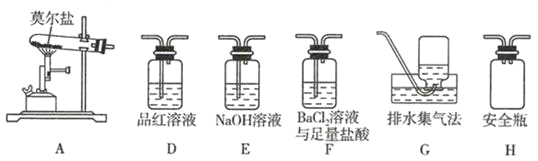
【题目】某化学兴趣小组借助![]() 的仪器装置完成有关实验。
的仪器装置完成有关实验。

(1)用装置A收集NO气体,正确的操作是 ______ ![]() 填序号
填序号![]() 。
。
a.从①口进气,用排水法集气
b.从①口进气,用排气法集气
c.从②口进气,用排水法集气
d.从②口进气,用排气法集气
(2)B装置中的恒压分液漏斗有两个作用,其一是平衡气压使分液漏斗内的液体能顺利滴下,其另一个作用是 ______。
(3)三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。某校一化学实验小组通过实验来探究一红色粉末是![]() 、
、![]() 或二者混合物。探究过程如下:
或二者混合物。探究过程如下:
查阅资料:
![]() 是一种碱性氧化物,溶于稀硫酸生成Cu和
是一种碱性氧化物,溶于稀硫酸生成Cu和![]() ,在空气中加热生成CuO
,在空气中加热生成CuO
提出假设:
假设1:红色粉末是![]()
假设2:红色粉末是![]()
假设3:红色粉末是![]() 和
和![]() 的混合物
的混合物
设计探究实验:
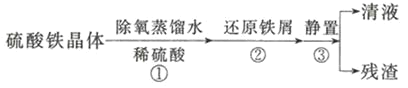
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加KSCN试剂。
①若滴加KSCN试剂后溶液不变红色,甲同学认为原固体粉末中一定不含三氧化二铁.乙同学认为其结论不正确,乙同学的理由是 ______。
②若固体粉末完全溶解无固体存在,滴加KSCN试剂时溶液不变红色,则证明原固体粉末是 ______。
![]() 经分析,确定红色粉末为
经分析,确定红色粉末为![]() 和
和![]() 的混合物.实验小组欲利用该红色粉末制取较纯净的胆矾
的混合物.实验小组欲利用该红色粉末制取较纯净的胆矾![]() 。经查阅资料得知,在溶液中通过调节溶液的酸碱性而使
。经查阅资料得知,在溶液中通过调节溶液的酸碱性而使![]() 、
、![]() 、
、![]() 分别生成沉淀的pH如下:
分别生成沉淀的pH如下:
物质 |
|
|
|
开始沉淀pH | 6.0 |
|
|
沉淀完全pH | 13 | 14 |
|
实验室有下列试剂可供选择:![]() 氯水
氯水 ![]()
![]()
![]()
实验小组设计如下实验方案:
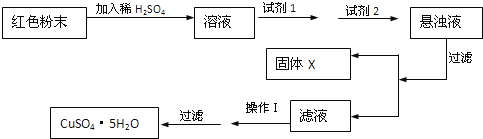
试回答:
①试剂为1____ ![]() 填字母
填字母![]() ,写出溶液中发生反应的离子方程式
,写出溶液中发生反应的离子方程式![]() 写出一个即可
写出一个即可![]() ___。
___。
②试剂为2______ ![]() 填字母
填字母![]() 。
。
③固体X的化学式为 ______。
④操作I为 ______。
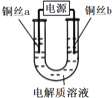
【题目】某小组同学用如下装置电解食盐水,并对电解产物进行探究。
实验装置 | 电解质溶液 | 实验现象 | |
|
| a极附近 | b极附近 |
开始时,产生白色浑浊并逐渐增加,当沉入U形管底部时部分沉淀变为橙黄色;随后a极附近沉淀自下而上也变为橙黄色 | 产生无色气泡 | ||
资料显示:
①氯化亚铜(CuCl)为白色粉末,微溶于水;
②氢氧化亚铜(CuOH)为黄色不溶于水的固体,易脱水分解为红色的![]() ;
;
③![]() 水溶液中不稳定,酸性条件下易歧化为
水溶液中不稳定,酸性条件下易歧化为![]() 和Cu;
和Cu;
④氢氧化铜可以溶于浓NaOH得到蓝色溶液.
![]() 经检验,b极产生的气体是
经检验,b极产生的气体是![]() ,b极附近溶液的pH______
,b极附近溶液的pH______![]() 填“增大”、“减小”、或“不变”
填“增大”、“减小”、或“不变”![]() ;铜丝a应与电源的______
;铜丝a应与电源的______![]() 填“正”或“负”
填“正”或“负”![]() 极相连。
极相连。
![]() 同学们分析a极附近生成的白色浑浊是CuCl,则该极的电极反应式是______。
同学们分析a极附近生成的白色浑浊是CuCl,则该极的电极反应式是______。
![]() ①橙黄色沉淀中含有
①橙黄色沉淀中含有![]() ,则CuCl转化为
,则CuCl转化为![]() 的原因是______
的原因是______![]() 用方程式表示
用方程式表示![]() ;
;
②结合离子在溶液中的运动规律,解释“
![]() 同学们通过实验进一步证实沉淀中含有
同学们通过实验进一步证实沉淀中含有![]() :将橙黄色沉淀滤出洗涤后,滴加
:将橙黄色沉淀滤出洗涤后,滴加![]()
![]() 至过量,应观察到的现象是______。
至过量,应观察到的现象是______。
![]() 同学们根据上述实验提出猜想:电解时,Cu做阳极先被氧化为
同学们根据上述实验提出猜想:电解时,Cu做阳极先被氧化为![]() 。为此,他们用Cu电极电解
。为此,他们用Cu电极电解![]() NaOH溶液,实验时观察到阳极产生大量无色气泡,附近溶液变蓝,未见预期的黄色沉淀。根据现象能否得出“该猜想不成立”的结论,并说明理由:______。
NaOH溶液,实验时观察到阳极产生大量无色气泡,附近溶液变蓝,未见预期的黄色沉淀。根据现象能否得出“该猜想不成立”的结论,并说明理由:______。
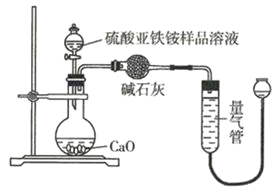
【题目】已知某气态化石燃料X中只含有碳、氢两种元素,为探究该气体中碳和氢两种元素的质量比,某同学设计了燃烧法测量的实验方案,通过测量装置C和D的增重即可求得碳和氢两种元素的质量比.实验装置如下图所示![]() 已知CuO可以作为碳氢化合物燃烧的催化剂
已知CuO可以作为碳氢化合物燃烧的催化剂![]() :
:

(1)若A装置中所盛放的药品是浓NaOH溶液,装置A的作用有:
①______;
②______
(2)D装置中所盛放的药品是______,
(3)E装置的作用是______,
(4)上述装置中有一处缺陷,请改正______.
(5)若实验装置经过改正后,得到的实验数据如下:
质量 | 实验前 | 实验后 |
药品 |
|
|
药品 |
|
|
则该气体中碳和氢两种元素的质量比为______.
【题目】下面两表分别列出了CO和![]() 的某些性质及相关键能,有关说法不正确的是
的某些性质及相关键能,有关说法不正确的是
表1:
分子 | 熔点 | 沸点 | 常温时在水 中溶解度 |
CO |
|
|
|
|
|
|
|
表2:
CO |
|
|
|
键能 |
|
| |
|
|
|
|
键能 | 193 | 418 | 946 |
A.CO与![]() 的价电子总数相等
的价电子总数相等
B.由表2可知,CO的活泼性不及![]()
C.由表1可知,CO的熔沸点高于![]() ,是因为CO分子间作用力大于
,是因为CO分子间作用力大于![]()
D.由表1可知,室温时,CO在水中的溶解性大于![]() ,是因为CO分子有弱极性
,是因为CO分子有弱极性