题目内容
下列块状金属在常温下能全部溶于足量的浓硝酸的是
| A.Au | B.Cu | C.Fe | D.Al |
B
解析试题分析:A、金是极不活泼金属,故不能溶于浓硝酸,错误;B、Cu是不活泼金属,但浓硝酸具有强氧化性,故能溶解铜,正确;C、常温下铁的表面被浓硝酸钝化,生成一层致密的氧化膜,可保护内层的铁,错误;D、常温下铝的表面被浓硝酸钝化,生成一层致密的氧化膜,可保护内层的铝,错误。
考点:考查浓硝酸的强氧化性、金属活动顺序表等相关知识。

练习册系列答案
 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案
相关题目
已知硫铁矿在沸腾炉中燃烧,通入的气体原料为空气,其中N2的体积分数为0.8,则沸腾炉中排除的气体中SO2的体积分数可能是( )
| A.0.13 | B.0.16 | C.0.22 | D.0.26 |
如图是某研究小组采用电解法处理石油炼制过程中产生的大量H2S废气的工艺流程。该方法对H2S的吸收率达99%以上,并可制取H2和S。下列说法正确的是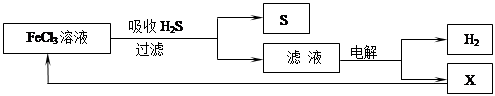
| A.吸收H2S的离子方程式为:2Fe3++H2S→2Fe2++S↓+2H+ |
| B.电解过程中的阳极反应主要为:2Cl-—2e-→Cl2 |
| C.该工艺流程体现绿色化学思想 |
| D.实验室可用点燃充分燃烧的方法消除H2S污染 |
无色的混合气体甲,可能含有NO、CO2、NO2、NH3、N2中的几种,将100mL甲气体经过如图实验的处理,结果得到酸性溶液,而几乎无气体剩余,则甲气体的组成为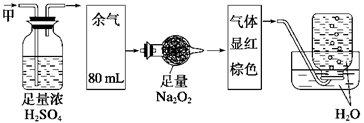
| A.Na2O2在此过程中作氧化剂 | B.甲气体的组成为NH3、NO、CO2 |
| C.甲气体的组成为NH3、NO2、CO2 | D.甲气体中NH3的体积分数为20% |
下列物质中只含有Cl2分子的是
| A.氯水 | B.液氯 | C.盐酸 | D.食盐 |
下列关于SO2性质的分析,肯定错误的是
| A.通入Ca(ClO)2溶液中,有HClO生成 | B.通入FeCl3溶液中,有SO42-生成 |
| C.通入氯水中,有淡黄色沉淀生成 | D.通入KICl2溶液中,有I-生成 |
已知KMnO4与浓盐酸在常温下反应能产生Cl2。若用下图所示的实验装置来制备纯净、干燥的氯气,并试验它与金属的反应。每个虚线框表示一个单元装置,其中有错误的是…( )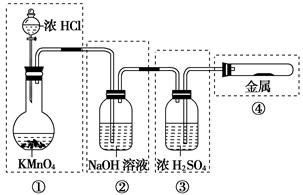
| A.①和②处 | B.②处 | C.②和③处 | D.②③④处 |