题目内容
【题目】某化学兴趣小组用铜和浓硫酸制取SO2,并依次检验SO2具有酸性氧化物的性质和还原性、漂白性、氧化性,所用仪器如下图所示(图中连接胶管、夹持和加热装置省略):
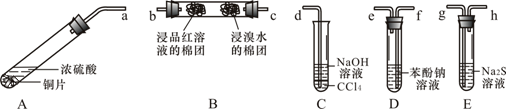
查阅资料可知,HSO3- 的酸性强弱与H2CO3相近。请回答下列问题:
(1)装置A中发生反应的化学方程式是:A
(2)上述装置的接口连接顺序依次是a→ → → → →g→h→d(填导管接口字母)。
(3)证明SO2具有氧化性的现象是 ;证明SO2具有还原性的实验中,反应的离子方程式是 。
(4)C试管中NaOH溶液的作用是 ,CCl4的作用是 。
【答案】(1)Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O(2)a f e c b g h d (全对给2分,否则给0分)
CuSO4+SO2↑+2H2O(2)a f e c b g h d (全对给2分,否则给0分)
(3)E试管中溶液变浑浊 SO2+Br2+2H2O=SO42-+2Br-+4H+
(4)吸收未反应完的SO2,以免污染空气 防止溶液倒吸
【解析】
试题分析:铜和浓硫酸在装置A中发生反应制取SO2,反应的化学方程式是:Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O;(2)由于要依次检验SO2具有酸性氧化物的性质和还原性、漂白性、氧化性,所以应该讲产生的气体先通过D装置。发生反应:SO2+2C6H5ONa+H2O=2C6H5OH↓+Na2SO3,看到在D装置中出现浑浊;证明了SO2具有酸性氧化物的性质,装置中导管连接方法是长进短出;再把从装置D导出的气体通入到B装置中,通过c进入,发生反应:SO2+Br2+2H2O=SO42-+2Br-+4H+,溴单质的元素变浅,证明了SO2具有还原性;在左端遇品红溶液变为无色,又证明了SO2具有漂白性;再把气体导入E 装置,发生反应:SO2+Na2S+2H2O=Na2SO3+H2S;SO2+2H2S=3S↓+2H2O,溶液变浑浊,证明了SO2具有氧化性。由于SO2和H2S都是有毒的气体,会造成大气污染,因此应该用碱溶液进行尾气处理,最后通入C装置,既吸收未反应完的SO2,也防止溶液倒吸。装置导管的连接顺序是a f e c b g h d。
CuSO4+SO2↑+2H2O;(2)由于要依次检验SO2具有酸性氧化物的性质和还原性、漂白性、氧化性,所以应该讲产生的气体先通过D装置。发生反应:SO2+2C6H5ONa+H2O=2C6H5OH↓+Na2SO3,看到在D装置中出现浑浊;证明了SO2具有酸性氧化物的性质,装置中导管连接方法是长进短出;再把从装置D导出的气体通入到B装置中,通过c进入,发生反应:SO2+Br2+2H2O=SO42-+2Br-+4H+,溴单质的元素变浅,证明了SO2具有还原性;在左端遇品红溶液变为无色,又证明了SO2具有漂白性;再把气体导入E 装置,发生反应:SO2+Na2S+2H2O=Na2SO3+H2S;SO2+2H2S=3S↓+2H2O,溶液变浑浊,证明了SO2具有氧化性。由于SO2和H2S都是有毒的气体,会造成大气污染,因此应该用碱溶液进行尾气处理,最后通入C装置,既吸收未反应完的SO2,也防止溶液倒吸。装置导管的连接顺序是a f e c b g h d。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量。实验步骤如下:
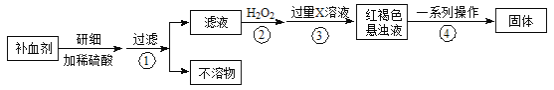
请回答下列问题:
(1)补血剂存放时间较长会氧化变质,对滤液中铁元素的存在形式提出如下假设:
假设1:只有Fe2+
假设2:只有Fe3+
假设3: 。
(2)如何证明步骤①滤液中含有Fe2+ 。
(3)步骤④中一系列处理的操作步骤: 、洗涤、灼烧、 、称量。
(4)该小组有些同学认为可用酸化的KMnO4溶液滴定进行Fe2+含量的测定。
①用离子方程式表示该滴定原理:____________________
②实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的仪器除天平、玻璃棒、烧杯、量筒、药匙、胶头滴管外,还需 。
重复滴定三次,消耗1.00 mol/L KMnO4标准溶液体积分别为19.98 mL、20.00 mL、20.02mL,3次实验所用Fe2+溶液的体积为20.00 mL。请根据以上数据,再设计合理数据,完成下列实验过程的记录表格。(必须填满)
实验编号 | Fe2+溶液的 体积/mL | |||
1 | 20.00 | |||
2 | 20.00 | |||
3 | 20.00 |
③如何判断达到滴定终点:____________________________。