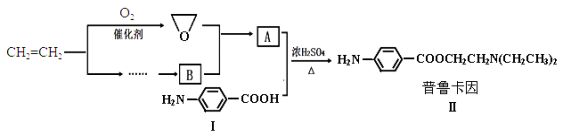
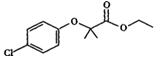
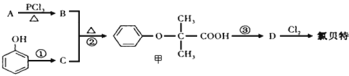
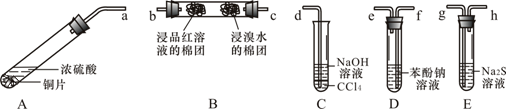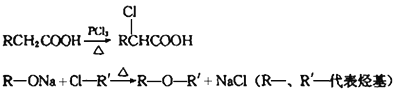题目内容
【题目】硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量。实验步骤如下:
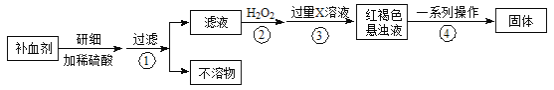
请回答下列问题:
(1)补血剂存放时间较长会氧化变质,对滤液中铁元素的存在形式提出如下假设:
假设1:只有Fe2+
假设2:只有Fe3+
假设3: 。
(2)如何证明步骤①滤液中含有Fe2+ 。
(3)步骤④中一系列处理的操作步骤: 、洗涤、灼烧、 、称量。
(4)该小组有些同学认为可用酸化的KMnO4溶液滴定进行Fe2+含量的测定。
①用离子方程式表示该滴定原理:____________________
②实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的仪器除天平、玻璃棒、烧杯、量筒、药匙、胶头滴管外,还需 。
重复滴定三次,消耗1.00 mol/L KMnO4标准溶液体积分别为19.98 mL、20.00 mL、20.02mL,3次实验所用Fe2+溶液的体积为20.00 mL。请根据以上数据,再设计合理数据,完成下列实验过程的记录表格。(必须填满)
实验编号 | Fe2+溶液的 体积/mL | |||
1 | 20.00 | |||
2 | 20.00 | |||
3 | 20.00 |
③如何判断达到滴定终点:____________________________。
【答案】(1)既有Fe2+又有Fe3+
(2)取少量滤液加入试管中,滴加几滴酸性KMnO4溶液,振荡KMnO4溶液褪色,说明含有Fe2+。
(3)过滤、 冷却
(4)①5Fe2++MnO4—+8H+=5Fe3++Mn2++4H2O ②250mL容量瓶
(6分)
实验编号 | Fe2+溶液的体积/mL | 1.00mol/LKMnO4溶液的起始读数/mL | 1.00mol/LKMnO4溶液的终止读数/mL | 消耗1.00mol/LKMnO溶液的体积/mL |
1 | 20.00 | 0.00 | 19.98 | 19.98 |
2 | 20.00 | 0.00 | 20.00 | 20.00 |
3 | 20.00 | 0.00 | 20.02 | 20.02 |
③滴入最后一滴酸性KMnO4溶液,溶液由无色变为紫红色,30秒内不恢复。
【解析】
试题分析:(1)根据题意,只有三种可能,其中的任意一种或两种都有,可得答案;(2)此题考查Fe2+的检验,由于溶液中可能含有Fe3+,进行检验时只能利用Fe2+的还原性,可使酸性KMnO4溶液褪色进行检验;(3)步骤④之前得到的是红褐色的悬浊液,需要过滤获得不溶物,经过灼烧,称量之前需要冷却;(4)①KMnO4具有强氧化性,可以将Fe2+氧化为Fe3+,而自身被还原为Mn2+,根据溶液显酸性,利用电子守恒和电荷守恒配平得下列方程式;5Fe2++MnO4—+8H+=5Fe3++Mn2++4H2O②配制KMnO4溶液,需要用到天平、玻璃棒、烧杯、量筒、药匙、胶头滴管、250 mL容量瓶,少了250 mL容量瓶;根据表格所给信息,进行滴定操作时,需要对初始读数、终止读数以及消耗溶液的体积进行记录,所以空格中应为这三项数据,要注意所消耗的体积=(终止读数—初始读数),所以最简单的方法是将初始读数都调节为0.00ml,但也可以其他数据,只需相对应即可;③滴定终点即为恰好完全反应时溶液的变化,用KMnO4滴定Fe2+溶液,应为一开始滴入的KMnO4被消耗完,无色,当Fe2+被消耗完时,再滴入一滴KMnO4,溶液将变为紫色,且30s不褪色,此为滴定终点。