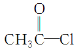题目内容
二氧化氯(ClO2)是目前国际上公认的第四代高效、无毒的消毒剂,是一种黄绿色的气体,易溶于水。
Ⅰ.(1)ClO2可由KClO3在H2SO4存在的条件下与Na2SO3反应制得。则该反应的氧化产物与还原产物的物质的量之比是________。
Ⅱ.实验室也可用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料制备ClO2,其流程如下:
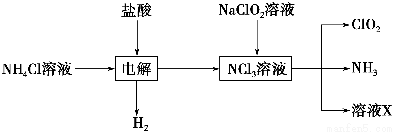
(2)写出电解时发生反应的化学方程式:________________________________。
(3)除去ClO2中的NH3可选用的试剂是________。(填序号)
A.饱和食盐水 B.碱石灰
C.浓硫酸 D.水
(4)测定ClO2(如图)的过程如下:在锥形瓶中加入足量的碘化钾,用100 mL水溶解后,再加3 mL硫酸溶液;在玻璃液封管中加入水;将生成的ClO2气体通过导管在锥形瓶中被吸收;将玻璃封管中的水封液倒入锥形瓶中,加入几滴淀粉溶液,用c mol·L-1硫代硫酸钠标准溶液滴定(I2+2S2O32-=2I-+S4O62-),共用去V mL硫代硫酸钠溶液。
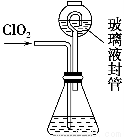
①装置中玻璃液封管的作用是______________________________________。
②请写出上述二氧化氯气体与碘化钾溶液反应的离子方程式__________________________。
③滴定终点的现象是_______________________________________________。
④测得通入ClO2的质量m(ClO2)=________。(用含c、V的代数式表示)
(5)用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子ClO2-。2001年我国卫生部规定,饮用水的ClO2-含量应不超过0.2 mg·L-1。若饮用水中ClO2-的含量超标,可向其中加入适量的某还原剂,该反应的氧化产物是________(填化学式),其发生反应的离子方程式为_________________________________________________________________。
(1)1∶2
(2)NH4Cl+2HCl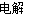 3H2↑+NCl3 (3)C
3H2↑+NCl3 (3)C
(4)①吸收残余的二氧化氯气体,并使锥形瓶内外压强相等 ②2ClO2+10I-+8H+=4H2O+5I2+2Cl- ③滴下最后一滴Na2S2O3溶液时,溶液由蓝色变为无色,且半分钟内不复原 ④1.35cV×10-2 g
(5)Fe(OH)3 ClO2-+4Fe2++2H2O+8OH-=4Fe(OH)3↓+Cl-
【解析】(1)设氧化产物Na2SO4、还原产物ClO2的物质的量分别为x、y,则2x=y,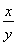 =
=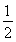 。
。
(2)根据电解时有H2、NCl3生成,所以电解时反应的化学方程式为NH4Cl+2HCl 3H2↑+NCl3。
3H2↑+NCl3。
(3)因为ClO2能和水、碱反应,所以应用浓硫酸除去NH3。(4)玻璃液封管中的水可以吸收残余的ClO2气体,并使锥形瓶内外压强相等。ClO2可把I-氧化成I2,离子方程式为2ClO2+10I-+8H+=4H2O+5I2+2Cl-,I2+2S2O32-=2I-+S4O62-
ClO2 ~ 5S2O32-
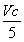 ×10-3 mol V×10-3L×c mol·L-1
×10-3 mol V×10-3L×c mol·L-1
=Vc×10-3mol
所以m(ClO2)=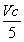 ×10-3mol×67.5 g·mol-1=1.35Vc×10-2g。
×10-3mol×67.5 g·mol-1=1.35Vc×10-2g。
(5)处理ClO2-可用Fe2+还原,其氧化产物为Fe(OH)3,离子方程式为ClO2-+4Fe2++2H2O+8OH-=4Fe(OH)3↓+Cl-。

将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)  2NH3(g)+CO2(g)
2NH3(g)+CO2(g)
实验测得不同温度下的平衡数据列于下表:
温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
平衡总压 强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
平衡气体总浓度/mol· L-1 | 2.4× 10-3 | 3.4× 10-3 | 4.8× 10-3 | 6.8× 10-3 | 9.4× 10-3 |
(1)可以判断该分解反应已经达到平衡的是________。
A.2v(NH3)=v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
(2)根据表中数据,列式计算25.0 ℃时的分解反应平衡常数:_______________。
(3)取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25.0 ℃下达到分解平衡。若在恒温下压缩容器体积,氨基甲酸铵固体的质量将________(填“增加”、“减少”或“不变”)。
研究物质的微观结构,有助于人们理解物质变化的本质。请回答下列问题:
(1)C、Si、N元素的电负性由大到小的顺序是___________________________,
C60和金刚石都是碳的同素异形体,二者相比,熔点高的是________,原因是____________________________。
(2)A、B均为短周期金属元素,依据表中数据,写出B的基态原子的电子排布式:________________。
电离能/(kJ·mol-1) | I1 | I2 | I3 | I4 |
A | 932 | 1 821 | 15 390 | 21 771 |
B | 738 | 1 451 | 7 733 | 10 540 |
(3)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般地,d0或d10排布无颜色,d1~d9排布有颜色。如[Co(H2O)6]2+显粉红色。据此判断:[Mn(H2O)6]2+________(填“无”或“有”)颜色。
(4)利用CO可以合成化工原料COCl2、配合物Fe(CO)5等。
①COCl2分子的结构式为 ,每个COCl2分子内含有________个σ键,________个π键,其中心原子采取________杂化轨道方式。
,每个COCl2分子内含有________个σ键,________个π键,其中心原子采取________杂化轨道方式。
②Fe(CO)5在一定条件下发生分解反应:Fe(CO)5(s)=Fe(s)+5CO(g)。反应过程中,断裂的化学键只有配位键,则形成的化学键类型是________。