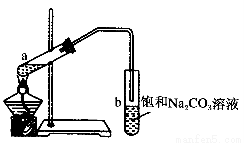
题目内容
从海带中提取碘单质的过程涉及氧化还原反应
B.往淡水中加入NaCl等配成人造海水,可用于海产品的长途运输
C.赤潮主要是由工农业生产和生活废水引起沿海水域的富营养化而造成的
D.海洋经济专属区的资源开发可获得Fe、Co、K、Au、Mg、B等金属
D
【解析】海水中的碘元素以碘离子(I-)的形式存在,要从海水中提取碘单质(I2)必然会涉及元素化合价的升降,即一定涉及氧化还原反应,故A项正确;赤潮主要是由于生活污水和工农业生产的废水任意排放导致水中N、P元素含量升高引起水域的富营养化而造成的,故C项正确;B不是金属元素,故D项错误。

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目
下表是元素周期表的一部分,有关说法正确的是( )
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
2 |
|
|
| c |
| d |
|
3 | a | b |
|
|
| e | f |
A.e的氢化物比d的氢化物稳定
B.a、b、e三种元素的原子半径:e>b>a
C.六种元素中,c元素单质的化学性质最活泼
D.c、e、f的最高价氧化物对应的水化物的酸性依次增强