题目内容
【题目】草酸铵[(NH4)2C2O4]为无色柱状晶体,不稳定,受热易分解,可用于测定Ca2+、Mg2+的含量。
I.某同学利用如图所示实验装置检验草酸铵的分解产物。

(1)实验证明草酸铵分解产物有:NH3、CO2、CO和水,其中说明分解产物中有CO的实验现象是__。
(2)装置C中发生反应的离子方程式为_____。
Ⅱ.该同学利用草酸铵测定某品牌牛奶中钙的含量,实验步骤如下:
①取100 mL牛奶,加入足量的草酸铵[(NH4)2C2O4]溶液,使牛奶中的钙转化成难溶的CaC2O4沉淀;
②过滤,用适量的蒸馏水洗涤沉淀表面吸附的少量(NH4)2C2O4、蛋白质等杂质;
③将沉淀转移至锥形瓶中,加足量的稀硫酸溶液溶解CaC2O4;
④然后以0.100mol·L-1的KMnO4溶液滴定生成的H2C2O4溶液,共消耗KMnO4溶液16.00mL。
已知:H++![]() +H2C2O4——Mn2++CO2+H2O(未配平)
+H2C2O4——Mn2++CO2+H2O(未配平)
(3)计算该品牌牛奶中钙的含量(单位:g·L-1),写出计算过程_____。
【答案】E中黑色固体变红,F中澄清石灰水变浑浊 CO2+2OH-=![]() +H2O n(KMnO4) =0.100mol·L-1×16.00×10-3L=1.6×10-3mol ,n(H2C2O4) =
+H2O n(KMnO4) =0.100mol·L-1×16.00×10-3L=1.6×10-3mol ,n(H2C2O4) =![]() n(KMnO4) =4×10-3mol ,n(Ca2+)=n(H2C2O4) =4×10-3mol,m(Ca2+)=4×10-3mol×40 g·mol=0.16g,该品牌牛奶中钙的含量为=
n(KMnO4) =4×10-3mol ,n(Ca2+)=n(H2C2O4) =4×10-3mol,m(Ca2+)=4×10-3mol×40 g·mol=0.16g,该品牌牛奶中钙的含量为=![]() = 1.6 g·L-1
= 1.6 g·L-1
【解析】
草酸铵分解产物有NH3、CO2、CO和水,澄清石灰水用于检验二氧化碳,足量氢氧化钠溶液吸收二氧化碳,浓硫酸用于除水,氧化铜与一氧化碳反应生成二氧化碳和铜;![]() 与H2C2O4发生氧化还原反应,锰元素由+7价变为+2价,碳元素由+3价变为+4价,根据得失电子守恒,可得反应方程式为6H++2
与H2C2O4发生氧化还原反应,锰元素由+7价变为+2价,碳元素由+3价变为+4价,根据得失电子守恒,可得反应方程式为6H++2![]() +5H2C2O4=2Mn2++10CO2+8H2O。
+5H2C2O4=2Mn2++10CO2+8H2O。
(1)综上分析,说明草酸铵的分解产物中有CO的实验现象是E中黑色固体变红,F中澄清石灰水变浑浊。
(2)装置C中总量氢氧化钠与二氧化碳反应生成碳酸钠和水,反应的离子方程式为CO2+2OH-=![]() +H2O。
+H2O。
(3)滴定过程中消耗高锰酸钾的物质的量为n(KMnO4) =0.100mol·L-1×16.00×10-3L=1.6×10-3mol,根据反应6H++2![]() +5H2C2O4=2Mn2++10CO2+8H2O可知,消耗的草酸的物质的量n(H2C2O4) =
+5H2C2O4=2Mn2++10CO2+8H2O可知,消耗的草酸的物质的量n(H2C2O4) =![]() n(KMnO4) =4×10-3mol,则n(Ca2+)=n(H2C2O4) =4×10-3mol,m(Ca2+)=4×10-3mol×40 g·mol=0.16g,该品牌牛奶中钙的含量=
n(KMnO4) =4×10-3mol,则n(Ca2+)=n(H2C2O4) =4×10-3mol,m(Ca2+)=4×10-3mol×40 g·mol=0.16g,该品牌牛奶中钙的含量=![]() = 1.6 g·L-1。
= 1.6 g·L-1。

 阅读快车系列答案
阅读快车系列答案【题目】在2 L密闭容器中,800℃时反应2NO(g)+O2(g) ![]() 2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K=________,已知:K(300℃)>K(350℃),该反应是________反应(填“放热”或“吸热”)。
(2)下图中表示NO2的变化的曲线是___,用O2的浓度变化表示从0~2 s内该反应的平均速率v=__________。
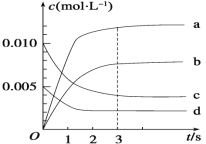
(3)能说明该反应已经达到平衡状态的是(____)
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内物质的密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是(____)
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效的催化剂
【题目】某学习小组在容积固定为2 L的密闭容器内充入1 mol N2和3 mol H2合成NH3。恒温下开始反应,并用压力传感器测定压强如下表所示:
反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
压强/MPa | 16.80 | 14.78 | 13.86 | 13.27 | 12.85 | 12.60 | 12.60 |
下列说法不正确的是
A.不断地将NH3液化并移走,有利于反应正向进行
B.其它条件不变,在30 min时,若压缩容器的体积,N2的平衡转化率增大
C.从反应开始到10 min时,v(NH3)=0.035 mol·L1·min1
D.在30 min时,再加入0.5 mol N2、1.5 mol H2和2 mol NH3,平衡向逆反应方向移动