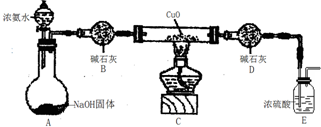
题目内容
13.用30g乙酸与46g乙醇反应,如果实际产率是理论产率的67%,则可得到的乙酸乙酯的质量是29.5g.分析 反应的方程式为:CH3COOH+CH3CH2OH$\frac{\underline{\;H_{2}SO_{4}\;}}{△}$CH3COOCH2CH3+H2O,根据乙酸和乙醇的质量关系判断反应的过量问题,结合方程式计算.
解答 解:30g乙酸的物质的量为$\frac{30g}{60g/mol}$=0.5mol,46g乙醇的物质的量为$\frac{46g}{46g/mol}$=1mol,
反应的方程式为CH3COOH+CH3CH2OH$\frac{\underline{\;H_{2}SO_{4}\;}}{△}$CH3COOCH2CH3+H2O,由此可知乙醇过量,则
CH3COOH+CH3CH2OH$\frac{\underline{\;H_{2}SO_{4}\;}}{△}$CH3COOCH2CH3+H2O
1mol 1mol
0.5mol×67% n
n=0.5mol×67%=0.335mol
m(CH3COOCH2CH3)=0.335mol×88g/mol=29.5g,
故答案为:29.5g.
点评 本题考查化学方程式的计算,题目难度不大,注意反应的理论产率的运用以及反应方程式的书写.

练习册系列答案
相关题目
1.下列合成路线中,涉及到的反应类型有( )
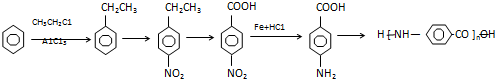

| A. | 加成反应 | B. | 氧化反应 | C. | 还原反应 | D. | 加聚反应 | ||||
| E. | 缩聚反应 |
8.0.1mol NaHCO3中含有( )
| A. | 0.2mol Na+ | B. | 0.05mol CO${\;}_{3}^{2-}$ | ||
| C. | 6.02×1023个O | D. | 0.1mol H |
18.某同学在实验报告中记录下列数据,其中正确的是( )
| A. | 用25 mL量筒量取12.36 mL盐酸 | B. | 托盘天平称取8.75克食盐 | ||
| C. | 用酸式滴定管量取4.90mL硫酸 | D. | 用广泛pH试纸测得某溶液pH为3.5 |
2.每年6月5日是世界环境日,今年我国环保总局确定的主题是“人人参与,创建绿色家园”.下列措施不符合这一主题的是( )
| A. | 推广垃圾分类存放,分类回收,分类处理 | |
| B. | 改革传统采煤时将煤层气(瓦斯气,主要成分甲烷)直接排入空气的做法,采用先开采和综合利用煤层气,然后再采煤的方法 | |
| C. | 推荐使用手帕,尽量减少使用面纸 | |
| D. | 将工厂的烟囱造高,以减少工厂周围的大气污染 |
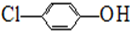 ),其原理如图1所示.
),其原理如图1所示.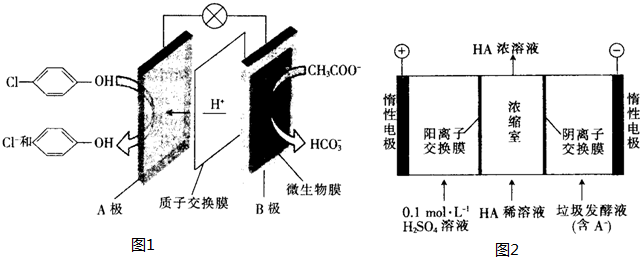
 -OH+2e-+H+═
-OH+2e-+H+═ -OH+Cl-.
-OH+Cl-.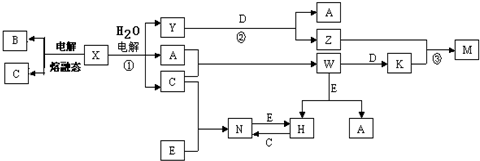
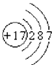 .
.
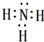 .
.