题目内容
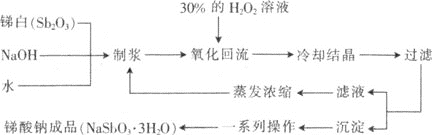
【题目】锑酸钠(NaSbO3)具有广泛的应用,可用作显像管、光学玻璃和各种高级玻璃的澄清剂,纺织品、塑料制品的阻燃剂,搪瓷乳白剂,制造铸件用漆的不透明填料及铁皮、钢板抗酸漆的成分。工业上用双氧水氧化法制备NaSbO33H2O的工艺流程如下:
回答下列问题:
⑴NaSbO33H2O中Sb的化合价为________。
⑵先将锑白、氢氧化钠和水按一定的比例制浆,制浆过程中,搅拌、加热的目的是________。
⑶将制得的浆液加热至适当温度后,慢慢滴入30%的H2O2溶液进行氧化回流,温度不宜过高的原因是________。此过程中涉及反应如下,配平此化学方程式:
____Sb2O3 + ____H2O2 + ____NaOH + ____H2O = ____NaSbO33H2O。
⑷此流程中,可以循环利用的主要物质有________。
⑸“沉淀”主要成分为锑酸钠,流程中“一系列操作”主要包括________,产品在90~100℃下烘干,温度不宜太高的原因是________________________________。
【答案】+5 加快反应速率 温度过高,H2O2易分解 1 2 2 3 2 NaOH 洗涤、干燥 NaSbO33H2O易失水
【解析】
⑴NaSbO33H2O中元素化合价代数和为0求Sb的化合价;
⑵为了使其充分反应,加快反应速率,采用搅拌、加热的操作;
⑶H2O2不稳定,易分解,温度越高,分解速度越快,Sb元素的化合价由+3价变为+5价,H2O2中的O元素有-1价变为-2价,利用化合价升降法可以配平方程式;
⑷为了使锑酸钠结晶析出,加入的NaOH为过量,分离出晶体后母液中还含有较多的NaOH,故可以循环利用;
⑸晶体表面有少量可溶于水的杂质,需要洗涤、干燥,烘干温度过高,会使晶体失去结晶水。
⑴NaSbO33H2O中元素化合价代数和为0,则Sb的化合价为+5,故答案为:+5;
⑵固体药品和溶液混合后,为了使其充分反应,加快反应速率,采用搅拌、加热的操作,故答案为:加快反应速率;
⑶H2O2不稳定,易分解,温度越高,分解速度越快,Sb元素的化合价由+3价变为+5价,H2O2中的O元素有-1价变为-2价,利用化合价升降法可以配平方程式为:Sb2O3 + 2H2O2 + 2NaOH +3H2O = 2NaSbO33H2O,故答案为:温度过高,H2O2易分解;1,2,2,3,2;
⑷为了使锑酸钠结晶析出,加入的NaOH为过量,分离出晶体后母液中还含有较多的NaOH,故可以循环利用,故答案为:NaOH;
⑸滤出的锑酸钠晶体表面有少量可溶于水的杂质,需要洗涤、干燥;烘干温度过高,会使晶体失去结晶水,故答案为:洗涤、干燥;NaSbO33H2O易失水。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】从明矾[KAl(SO4)2·12H2O]制备Al、K2SO4和H2SO4的流程如下:
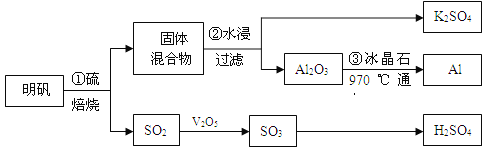
已知:明矾焙烧的化学方程式为:4[KAl(SO4)2·12H2O] + 3S=2K2SO4+ 2Al2O3 + 9SO2↑+ 48H2O
请回答下列问题:
(1)在焙烧明矾的反应中,氧化产物与还原产物的物质的量之比为: 。
(2)步骤②中,为提高浸出率,可采取的措施有_____________。
A.粉碎固体混合物 | B.降低温度 | C.不断搅拌 | D.缩短浸泡时间 |
(3)明矾焙烧完全后,从步骤②的滤液中得到K2SO4晶体的方法是 。
(4)步骤③电解的化学方程式是 ,电解池的电极是用碳素材料做成,电解过程中,阳极材料需要定期更换,原因是: 。
(5)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)
转化为Ni(OH)2,则该电池的正极电极反应式是 。
(6)焙烧a吨明矾(摩尔质量为b g/mol),若SO2的转化率为96%,可生产质量分数为98%的H2SO4质量为 吨(列出计算表达式)。
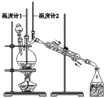
【题目】已知:CH3CH2CH2CH2OH![]() CH3CH2CH2CHO;利用如图装置用正丁醇合成正丁醛相关数据如表:
CH3CH2CH2CHO;利用如图装置用正丁醇合成正丁醛相关数据如表:
物质 | 沸点/℃ | 密度 / gcm-3 | 水中溶解性 |
|
正丁醇 | 117.2 | 0.8109 | 微溶 | |
正丁醛 | 75.7 | 0.8017 | 微溶 |
下列说法中,不正确的是
A.为防止产物进一步氧化,应将酸化的Na2Cr2O7溶液逐滴加入正丁醇中
B.当温度计1示数为90~95℃,温度计2示数在76℃左右时,收集产物
C.反应结束,将馏出物倒入分液漏斗中,分去水层,粗正丁醛从分液漏斗上口倒出
D.向获得的粗正丁醛中加入少量金属钠,检验其中是否含有正丁醇