题目内容
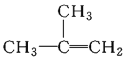
【题目】已知反应A2(g) + 2B2(g)![]() 2AB2(g) ΔH < 0,列说法正确的是 ( )
2AB2(g) ΔH < 0,列说法正确的是 ( )
A.升高温度,正向反应速率增加,逆向反应速率减小
B.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动
C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动
D.升高温度有利于反应速率增加,从而缩短达到平衡的时间
【答案】D
【解析】
A选项,升高温度正、逆反应速率都增大,故A错误;
B选项,该反应正反应是体积减小的放热反应,降低温度有利于平衡向正反应方向移动,减小压强有利于平衡向逆反应方向移动,故B错误;
C选项,该反应正反应是体积减小的放热反应,升高温度有利于平衡向逆反应方向移动,减小压强有利于平衡向正反应方向移动,故C错误;
D选项,升高温度反应速率加快,缩短到达平衡的时间,故D正确。
综上所述,答案为D。

练习册系列答案
相关题目