题目内容
下列物质都能与金属钠反应放出H2,产生H2的速率排序正确的是
①C2H5OH ②NaOH溶液 ③醋酸溶液
| A.③﹥②﹥① | B.②﹥①﹥③ | C.①﹥②﹥③ | D.③﹥①﹥② |
A
解析试题分析:醋酸是弱电解质,溶于水显酸性,使溶液中的H+浓度增大,NaOH溶液中有H2O的电离,C2H5OH是非电解质,所以醋酸溶液与金属钠反应速率最快,C2H5OH与金属钠反应速率最慢。
考点:影响反应速率的外界因素。

 阅读快车系列答案
阅读快车系列答案由可逆反应绘出图像如图,纵坐标为生成物在平衡混合物中的百分含量,下列对该反应的判断正确的是 ( )
| A.反应物中一定有气体 | B.生成物中一定有气体 |
| C.正反应一定是放热反应 | D.正反应一定是吸热反应 |
在密闭容器中,对于反应2SO2(g)+O2(g)  2SO3(g),SO2和O2起始时分别为20mol和10 mol;达平衡时,SO2的转化率为80%。若从SO3开始进行反应,在相同的温度下,欲使平衡时各成分的百分含量与前者相同,则起起始时SO3的物质的量及其转化率为
2SO3(g),SO2和O2起始时分别为20mol和10 mol;达平衡时,SO2的转化率为80%。若从SO3开始进行反应,在相同的温度下,欲使平衡时各成分的百分含量与前者相同,则起起始时SO3的物质的量及其转化率为
| A.10 mol和 10% | B.20 mol和 80% | C.20 mol和 40% | D.20 mol和 20% |
在一定条件下,将E(g)和F(g)充入体积不变的2 L密闭容器中,发生下述反应,并于5 min末达到平衡:2E(g)+F(g) 2G(g)。有关数据如下:
2G(g)。有关数据如下:
| | E(g) | F(g) | G(g) |
| 初始浓度(mol?L-1) | 2.0 | 1.0 | 0 |
| 平衡浓度(mol?L-1) | c1 | c2 | 0.4 |
A.反应在前5min内,v(E)=0.04 mol/(L·min)
B.其他条件不变,若增大E的浓度,则达平衡时E的转化率会增大
C.其他条件不变,降低温度,平衡时n(E)=3.0mol,则反应的△H>0
D.平衡后移走2.0 mol E和1.0 mol F,在相同条件下再达平衡时,c(G)<0.2 mol?L-1
反应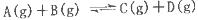 过程中的能量变化如图所示,下列说法错误的是
过程中的能量变化如图所示,下列说法错误的是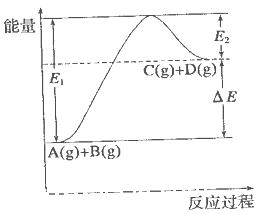
| A.该反应是吸热反应 |
| B.加入催化剂后,反应加快,A的转化率不变 |
| C.反应物的总键能小于生成物的总键能 |
| D.反应达到平衡时,升高温度,A的转化率增大 |
向甲、乙两个容积均为1 L的恒温恒容的密闭容器中,分别充入一定量的SO2和O2(其中,甲充入2 mol SO2、1 mol O2,乙充入1 mol SO2、0.5 mol O2),发生反应:2SO2(g)+O2(g)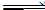 2SO3(g);ΔH=-197.74 kJ·mol-1。
2SO3(g);ΔH=-197.74 kJ·mol-1。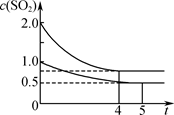
一段时间后达到平衡,测得两容器中c(SO2)(mol·L-1)随时间t(min)的变化关系如右图所示。下列说法正确的是( )
| A.热量:Q(甲)<2Q(乙) |
| B.压强:p(甲)<2p(乙) |
| C.乙中前5 min内的反应速率v(O2)=0.10 mol·L-1·min-1 |
| D.保持其他条件不变,若起始时向乙中充入0.4 mol SO2、0.2 mol O2、0.4 mol SO3,则此时v(正)<v(逆) |
已知反应4CO+2NO2 N2+4CO2在不同条件下的化学反应速率如下,其中表示反应速率最快的是( )
N2+4CO2在不同条件下的化学反应速率如下,其中表示反应速率最快的是( )
| A.v(CO)=1.5 mol·L-1·min-1 | B.v(NO2)=0.7 mol·L-1·min-1 |
| C.v(N2)=0.4 mol·L-1·min-1 | D.v(CO2)=1.1 mol·L-1·min-1 |
对于可逆反应2SO2+O2 2SO3,在混合气体中充入一定量的18O2,足够长的时间后,18O原子 ( )
2SO3,在混合气体中充入一定量的18O2,足够长的时间后,18O原子 ( )
| A.只存在于O2中 | B.只存在于O2和SO3中 |
| C.只存在于O2和SO2中 | D.存在于O2、SO2和SO3中 |
 2C(g),下列各数据表示同一反应速率是
2C(g),下列各数据表示同一反应速率是