题目内容
【题目】某校化学课外研究小组为研究浓硫酸与金属M 反应的气体生成物,进行了下列实验活动:
【提出假设】
假设1:气体生成物只有SO2;
假设2:气体生成物只有H2;
假设3:_______________________________________。
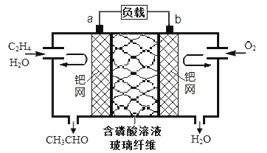
【实验验证】实验装置及实验中使用的试剂如图:

在装入药品前,甲同学检查装置A 的气密性,方法是________________________________________。
(2)乙同学通过所学知识排除了上面提出的一个假设,他排除的是假设_____,理由是______________________________________________________。
(3)如果假设3 正确,填写下表中的实验现象:
装置 | B | F | G |
实验现象 | _____ | _____ | _____ |
装置C 的作用是___________________________,写出装置C中发生反应的离子方程式__________________________________________________。
(5)装置D 的作用是________________________________________。
【答案】 【提出假设】气体生成物是SO2和H2 的混合气体 打开弹簧夹K1、K2、K3、K4,关闭分液漏斗活塞,将干燥管小口端连接一橡皮管并浸入水中,用酒精灯给圆底烧瓶微热,若末端的橡皮管出现连续而均匀气泡时,说明装置A 的气密性良好 2 浓硫酸具有强氧化性,在加热的条件下能被金属还原为SO2 品红溶液红色褪去 黑色固体变成红色 无水硫酸铜变蓝 除去可能未反应完的SO2 5SO2 +2MnO4- +2H2O==5SO42- +2Mn2+ + 4H+ 检验SO2 是否已除尽
【解析】【提出假设】假设1:气体生成物只有SO2;
假设2:气体生成物只有H2;
推断当金属过量时,且金属较活泼则生成的气体中可能含有氢气,所以假设3为:气体产物有SO2和H2 ;
【实验验证】
(1)在装入药品前,甲同学检查装置A的气密性需要密闭装置A,利用分液漏斗中加入水,观察液面变化,设计方法为:关闭弹簧夹K1,打开分液漏斗活塞,向分液漏斗中注入适量水,若分液漏斗滴下水的速度逐渐变慢,直至停止,则证明装置A的气密性良好;
(2)浓硫酸的性质可知,和金属加热条件下发生反应开始生成二氧化硫气体,当金属过量时,且金属较活泼则生成的气体中可能含有氢气,假设2一定是错误的;
(3)若生成的气体为二氧化硫和氢气,则装置中的反应现象为:二氧化硫具有漂白性通过装置B中品红溶液褪色,氢气通过装置F还原氧化铜为金属铜,出现黑色变为红色现象,生成的水蒸气通过装置G,无水硫酸铜白色变化为蓝色;为检验二氧化硫的存在和避免二氧化硫对后续实验的影响,通过装置C是利用二氧化硫的还原性被高锰酸钾溶液氧化除去,发生反应的离子方程式为5SO2 +2MnO4- +2H2O==5SO42- +2Mn2+ + 4H+;
(5)装置D中的品红溶液是检验二氧化硫是否除净。