题目内容
有五种短周期主族元素A、B、C、D、E,已知:五种元素原子序数依次增大,其中A、E的单质在常温下是气体,B元素原子的最外层电子数是电子层数的2倍,D元素的单质常用于野外焊接铁轨,C元素是所在周期主族元素中原子半径最大的一种。(1)试写出A、B两种元素形成的不含有非极性键的化合物的电子式:______________;
(2)试写出工业上用电解方法冶炼D单质的化学方程式____________________________;
(3)写出C单质在空气中燃烧的化学方程式,并标出电子转移的方向和数目:______________;
(4)写出实验室制取单质E的化学方程式:____________________________。
(1)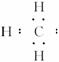
(2)2Al2O3![]() 4Al+3O2↑
4Al+3O2↑
(3)![]()
(4)MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
解析:B元素若为第二周期,则是碳,若为第三周期则是硫,但原子序数比硫大的短周期元素只有氯,故不符合,所以B只能是碳。在野外焊接铁轨用到的单质是Al,故D为铝,又因为A、E的单质在常温下为气体,则A为氢、E为氯。在同周期主族元素中原子半径最大的是碱金属元素,故C为Na。

练习册系列答案
相关题目
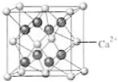 (4)B与Ca形成的晶体的晶胞如右图所示,其中Ca2+的配位数是
(4)B与Ca形成的晶体的晶胞如右图所示,其中Ca2+的配位数是